
科学研究发现,人类活动使大气中的二氧化碳含量发生大幅度的变化,这是造成“温室效应”的关键因素.为减缓大气中的二氧化碳大量增加,可能最有效的办法是
[ ]
A.立即减少煤和石油的燃烧
B.控制全球人口的急剧增长
C.植树造林、保护森林生态系统
D.将煤和石油转化为气态燃料
科目:高中化学 来源: 题型:阅读理解
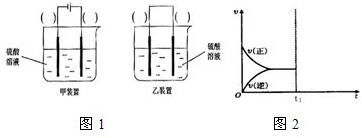
| 光 |
| Cu2O |
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
查看答案和解析>>
科目:高中化学 来源:诸城市模拟 题型:问答题
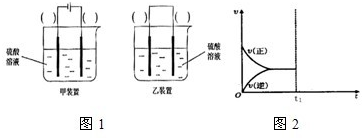
| 光 |
| Cu2O |
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
查看答案和解析>>
科目:高中化学 来源: 题型:
铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的离子方程式 。
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 。
(3)若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 。
(4)若混合物中Cu的物质的量为n mol,则n的取值范围为 。
(5)科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。当收集的N2体积为 3.36L(已换算为标准状况)时,可制备纳米级Cu2O的质量为 ;
查看答案和解析>>
科目:高中化学 来源:2010年山东省潍坊市四县市联考高考化学模拟试卷(解析版) 题型:解答题

 2H2(g)+O2(g)△H>0,不同时段产生O2的量见下表:
2H2(g)+O2(g)△H>0,不同时段产生O2的量见下表:| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com