
| A. | 用饱和碳酸钠溶液洗 | B. | 用盐酸洗 | ||
| C. | 用氢氧化钠溶液洗 | D. | 用水洗 |
科目:高中化学 来源: 题型:解答题
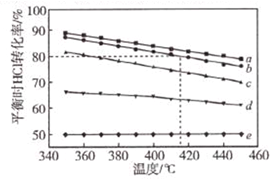 文献报道:利用氯化氢氧化反应一脱水耦合工艺,可用有机氯化工艺的副产品氯化氢为原料制备氯气,实现氯的循环利用,原理为4HCl(g)+O2(g)?2Cl2(g)+2H2O(g).将HC1和O2分别以5种物质的量比:①1:1 ②2:1 ③4:1 ④6:1 ⑤8:1,向五个容积可变的容器中投料时,反应温度对HCl平衡转化氯影响的曲线如图.
文献报道:利用氯化氢氧化反应一脱水耦合工艺,可用有机氯化工艺的副产品氯化氢为原料制备氯气,实现氯的循环利用,原理为4HCl(g)+O2(g)?2Cl2(g)+2H2O(g).将HC1和O2分别以5种物质的量比:①1:1 ②2:1 ③4:1 ④6:1 ⑤8:1,向五个容积可变的容器中投料时,反应温度对HCl平衡转化氯影响的曲线如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 负极反应为:Cu-2e-═Cu2+ | |
| B. | 若该原电池工作前两电极质量相等,则工作后,当铜的质量减少6.4g时,两电极质量相差21.6g(假设电解质溶液都是足量的) | |
| C. | 当铜的质量减小12.8 g时,外电路中通过0.4mol电子 | |
| D. | 原电池的总反应式为:Cu+2AgNO3═2Ag+Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
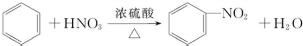
 下列给出了烃及烃的衍生物A、B、C、D、E的相关信息:
下列给出了烃及烃的衍生物A、B、C、D、E的相关信息: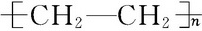 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:计算题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com