
【题目】一桥连三地,天堑变通途。举世瞩目的港珠澳大桥于2018年10月23日正式通车,体现了我国工程建设自主创新能力实现大跨越,尤其在新材料研究方面有重大突破,回答下列问题:
(1)钛是一种新兴的结构材料,比钢轻、比铝硬。
①基态钛原子的价电子排布式为______,与钛同周期的元素中,基态原子的未成对电子数与钛相同的有_____种
②钛的硬度比铝大的原因是_______________________________。
③工业上制金属钛采用金属还原四氧化钛。先将TiO2和足量炭粉混合加热至1000~1100K进行氯化处理,生成TiCl4。该反应的化学反应方程式为_______________________。
(2)跨海桥梁的主要结构材料为钢铁。铁能与三氮唑(Bipy,结构见图)形成多种配合物。

①1mol Bipy中所含![]() 键_____mol;碳原子杂化方式是___________________。
键_____mol;碳原子杂化方式是___________________。
②Bipy的沸点为260℃、结构相似且相対分子质量接近的环戊二烯(结构见上图)的沸点为42.5℃.前者较大的原因是______________________________。
(3)碳化钨是耐高温耐磨材料。下图为化晶体的部分结构,碳原子嵌入金属的晶格间隙,并不破坏原有金属的晶格,形成填隙+固溶体、也称为填隙化合物。
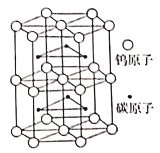
①在该结构中,每个钨原子周围距离钨原子最近的碳原子有____个。
②假设该部分晶体的体积为d/cm3,碳化的摩尔质量为Mg/mol,密度为dg/cm3,则阿伏加德罗常数NA用上述数据表示为______。
【答案】3d24s2 3 Ti原子的价电子数比Al多,金属键更强 TiO2+2C+2Cl2![]() TiCl4+2CO 8 sp2 bipy分子间可形成氢键,而环戊二烯不能 6 6M/dV
TiCl4+2CO 8 sp2 bipy分子间可形成氢键,而环戊二烯不能 6 6M/dV
【解析】
(1)①Ti是22号元素,价电子排布式为3d24s2;Ti有2个未成对电子,同周期有2个未成对电子的是Ni、Ge、Se三种;
②利用价电子数越多,金属键越强,硬度越大,Ti原子价电子为4,Al的价电子为3,Ti原子价电子数比Al多,Ti的金属键强,钛的硬度大于铝;
③该反应方程式为TiO2+2C+2Cl2![]() TiCl4+2CO;
TiCl4+2CO;
(2)①成键原子之间只能形成一个σ键,因此1molBipy中所含σ键物质的量为8mol;根据Bipy的结构简式,碳原子有3个σ键,无孤电子对,碳原子杂化类型为sp2;
②两种物质为分子晶体,前者能够形成分子间氢键,后者不能形成分子间氢键,因此Bipy的沸点高;
(3)①每个钨原子周围距离钨原子最近的碳原子有6个;
②结构中钨原子数目是1+2×1/2+12×1/6+6×1/3=6,碳原子个数为6,化学式为WC,晶胞质量为6×Mg·mol-1/NAmol-1,根据密度的定义,NA=6M/dV。


科目:高中化学 来源: 题型:
【题目】100℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。下列叙述中不正确的是:
A. 此时水的离子积Kw=1×10-14 B. 水电离出的c(H+)=1×10-10molL-1
C. 水的电离程度随温度升高而增大 D. c(Na+)=c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳生活,绿色出行”已经成为很多人的生活理念。CO2的捕捉和利用也成为了科学家们积极探索的热门领域。回答下列问题:
(1)用CO2催化加氢可制取乙烯,其能量关系如图1,写出该反应的热化学方程式____________。
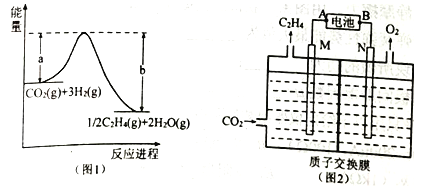
(2)以硫酸作电解质溶液,利用太阳能电池将CO2转化为乙烯的工作原理如图2。则A为电池的___极,N极的电极反应式为_________________________。
(3)用CO2催化加氢制取二甲醚的反应为:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
在恒容密闭容器中,均充入2mol.CO2和6molH2,分别以Ir和Ce作催化剂,反应进行相同的时间后测得的CO2的转化率a(CO2)随反应温度的变化情况如图3。
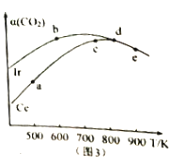
①用Ir和Ce作催化剂时,反应的活化能更低的是_______。
②a、b、c、d和e五种状态,反应一定达到平衡状态的是__________,反应的△H ___0(填“>”、“=”或“<”)。
③从状态a到c,CO2转化率不断增大的原因是________________________________。
④状态e时,a(CO2)= 50%,若保持容器容积为10L,则此时的平衡常数K=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以“火法粗炼”、“电解精炼”相结合的炼制精铜工艺流程如下,已知“还原”反应中,冰铜中的Cu2S先转化为Cu2O,然后Cu2O再与Cu2S反应生成粗铜。下列叙述正确的是
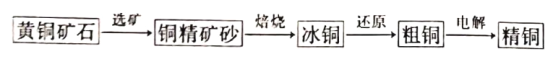
A. 该炼铜工艺对环境友好,不会产生大气污染物
B. “烙烧”过程中, CuFeS2既是氧化剂又是还原剂
C. 在Cu2S”还原”为Cu的总反应中,Cu2O作催化剂
D. “电解”时,金、银等贵金属被置换出来形成阳极泥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:
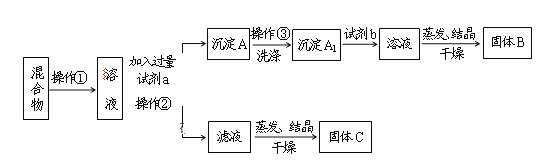
供选试剂:Na2SO4溶液、K2SO4溶液、K2CO3溶液、盐酸
(1)操作①的名称是____________,操作②的名称是_____________。
(2)试剂a是____________,固体B是___________。(填化学式)
(3)加入试剂b所发生的化学反应方程式为:______________________________________。
(4)该方案能否达到实验目的:________。若不能,应如何改进(若能,此问不用回答)_________。
(5)若要测定原混合物中KCl和BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是_________的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应进行到一定程度时,反应物、生成物浓度均不再改变这是因为
A. 反应停止了B. 某种反应物已完全反应
C. 正反应速率和逆反应速率相等D. 反应物和生成物的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钠在制革工业、印刷工业、电镀工业等有重要用途,制备重铬酸钠(Na2Cr2O7)的方案1的流程图如图,铬铁矿的主要成分可表示为FeO·Cr2O3,还含有Al2O3、Fe2O3、SiO2等杂质。

除此外工厂还有相关改进工艺,制备重铬酸钠(Na2Cr2O7)的方案2如图,采用电化学原理如图所示的装置(电极为石墨),通过电解提高阳极区溶液的酸性,实现Na2CrO4转化为Na2Cr2O7。

(1)在方案2中请指明哪端是阴极? ___________(填“左”或“右”)。写出阳极的电极方程式:______________________。
(2)方案1中煅烧前应将铬铁矿充分粉碎,其目的是______________________。灼烧是中学化学中常用的操作方法,如在实验室中将铬铁矿和碳酸钠固体混合物灼烧,下列各实验仪器中不需要的是___________(填序号)。
a.陶瓷坩埚 b.铁坩埚 c.三脚架 d.泥三角
转窑中发生的主要反应除了下面的两个反应外,还有其他反应。
①Na2CO3+Al2O3![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
②_____FeO·Cr2O3+______Na2CO3+______O2![]() ______Na2CrO4+______Fe2O3+______。
______Na2CrO4+______Fe2O3+______。
请配平反应②的化学方程式。
请写出其他主要反应方程式:_________________________________。
(3)固体Y的化学式为___________、___________。
(4)向母液中加入浓硫酸,把铬酸钠转化为重铬酸钠,经两次蒸发,主要是除去___________(填化学式),冷却至30-40℃得到产品晶体。洗涤该晶体的溶剂最好是___________(填序号)。
a.蒸馏水 b无水乙醇 c.75%乙醇溶液
(5)为了测定实验制得的产品中Na2Cr2O7,的含量,称取样品0.140g置于锥形瓶中,加50mL水;再加入2gKI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10min;然后加入150mL蒸馏水并加入3mL0.5%淀粉溶液;用0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00mL。(假定杂质不参加反应,已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,I2+2S2O32-===2I-+S2O62-)
①终点实验现象是_______________________________________________________。
②该产品中Na2Cr2O7的纯度为______________________。(以质量分数表示)
③若滴定管在滴定前俯视读数,滴定结束后仰视读数,测得样品的纯度将___________(填“偏高”或“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数的值,下列说法中正确的是
①该氯原子的相对原子质量为12a/b
②该氯原子的摩尔质量是aNA g
③m g该氯原子的物质的量为m/(aNA)mol
④a g该氯原子所含的电子数为17 mol
A. ①③ B. ②④ C. ①② D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是常温下向20.0 mL的盐酸中,逐滴加入0.10 mol·L-1 NaOH溶液时,溶液的pH随 NaOH溶液的体积V(mL)变化的曲线,根据图像所得的下列结论中正确的是
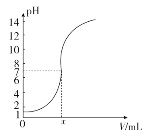
A. 原盐酸的浓度为0.10 mol·L-1
B. x的值为2.0
C. 当pH=12时,V值为20.4
D. 原盐酸的浓度为1.0 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com