
分析 碳酸为二元弱酸,分步电离;
一水合氨为弱电解质,部分电离出铵根离子和氢氧根离子;
碳酸氢钠属于强电解质,完全电离出钠离子和碳酸氢根离子,
NaHSO4是强电解质,完全电离出钠离子和硫酸根离子和氢离子.
解答 解:碳酸属于二元弱酸,分步电离,电离过程是可逆过程,电离方程式为:H2CO3?H++HCO3-,HCO3-?H++CO32-,
NH3•H2O为弱电解质,部分电离,电离方程式为:NH3•H2O?NH4++OH-;
碳酸氢钠属于盐,在水中电离出钠离子和碳酸氢根离子,电离方程式为:NaHCO3═Na++HCO3-,
NaHSO4是强电解质,NaHSO4在水中电离出钠离子和硫酸根离子和氢离子,NaHSO4═Na++H++SO42-,
故答案为:H2CO3?H++HCO3-,HCO3-?H++CO32-;NH3•H2O?NH4++OH-;NaHCO3═Na++HCO3;NaHSO4═Na++H++SO42-.
点评 本题考查电离方程式的书写知识,注意强电解质在溶液中能完全电离,弱电解质部分电离,离子团在电离方程式中不能拆开,强酸的酸式根离子要拆开,弱酸的酸式根离子不能拆开,碳酸氢钠电离为该题易错点,题目难度不大.


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:解答题
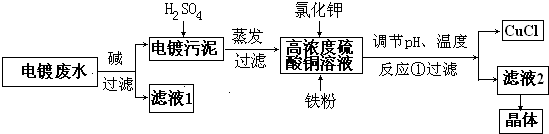

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将H2SO4溶液改为浓硫酸 | |
| B. | 用1mol/LH2SO4溶液代替原H2SO4溶液 | |
| C. | 用锌粉代替块状锌 | |
| D. | 用同浓度热的H2SO4溶液代替原H2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量碳酸钠粉末 | B. | 加入少量硫酸铜溶液 | ||
| C. | 加入适量NaCl溶液 | D. | 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验内容 | 实验现象 |
| 向2mL维生素C溶液中滴加2滴紫色石蕊试液 | 溶液变为红色 |
| 将维生素C的溶液逐滴加入到2mL溶有淀粉的碘水中 | 溶液由蓝色变为无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下NaHCO3产生的CO2体积大 | |
| B. | 等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3是NaHCO3的两倍 | |
| C. | 将石灰水加入NaHCO3溶液中不产生沉淀,加入Na2CO3溶液中产生白色沉淀 | |
| D. | 同物质的量浓度的两种溶液,Na2CO3溶液的碱性强于NaHCO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com