
 验完成下列问题:
验完成下列问题: 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源:不详 题型:填空题
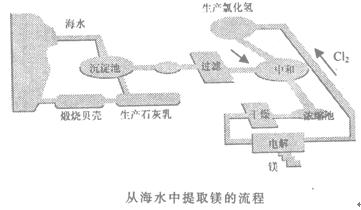
 ①将海边大量的贝壳煅烧成生石灰,并将生石灰制成石灰乳;
①将海边大量的贝壳煅烧成生石灰,并将生石灰制成石灰乳;
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3mol/L的HCl | B.4mol/L的HNO3 |
| C.8mol/L的NaOH | D.18mol/L的H2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
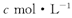 的氢氧化钠溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将所得沉淀灼烧至质量不再改变为止,得到固体p g0则下列关系不正确的是
的氢氧化钠溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将所得沉淀灼烧至质量不再改变为止,得到固体p g0则下列关系不正确的是A.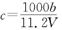 | B.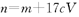 | C. | D. |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.甲、乙中都是铝过量 | B.甲中铝过量,乙中碱过量 |
| C.甲中酸过量,乙中铝过量 | D.甲中酸过量,乙中碱过量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.d="a+17b" | B.C1=C2V2/V1 |
| C.铝为 (24b-a)/9 mol | D.与金属反应后剩余盐酸为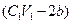 mol mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
A.Al(OH)3可溶于强碱溶液中,M g(OH)2不能 g(OH)2不能 |
| B.Mg能从铝盐溶液中置换出铝 |
| C.Mg 原子最外层只有2个电子, 而Al原子最外层有3个电子 |
| D.Mg与盐酸反应比铝与盐酸反应更剧烈 |
 点,都可以制耐火材料,其原因是_____________________
点,都可以制耐火材料,其原因是_____________________查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com