

| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲中B的体积分数增大,乙中B的体积分数减小 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
分析 从等效平衡的角度分析,4molC和2molD相当于2molA和4molB,即乙容器内的气体的物质的量为甲容器内的气体的物质的量的2倍,而乙容器的体积为甲容器的体积的2倍,在相同温度下达到相同平衡状态,在此基础上,从平衡移动的角度解答此题.
解答 解:从等效平衡的角度分析,4molC和2molD相当于2molA和4molB,即乙容器内的气体的物质的量为甲容器内的气体的物质的量的2倍,而乙容器的体积为甲容器的体积的2倍,在相同温度下达到相同平衡状态,
A、保持温度和活塞位置不变,在甲中再加入1molA和2molB,则相当于在原来的基础上增大压强,平衡向逆反应方向移动,达到平衡时,甲中C的浓度小于原来的2倍,即小于乙中C的浓度的2倍,故A错误;
B、保持活塞位置不变,升高两个容器的温度,平衡向逆反应方向移动,甲、乙中B的体积分数都增大,故B错误;
C、保持温度不变,移动活塞P,使乙的容积和甲相等,则乙容器内的压强增大,平衡向逆反应方向移动,达到新的平衡后,乙中C的体积分数小于甲中C的体积分数的2倍,故C错误;
D、甲温度和体积变化,加入氦气后对平衡移动没有影响,保持温度和乙中的压强不变,加入氦气后乙体积增大,平衡应向正反应方向移动,正逆反应速率都减小,故D正确.
故选D.
点评 本题考查化学平衡移动的影响因素,题目难度中等,注意从等效平衡的角度分析起始时甲乙两容器内的气体的平衡状态,在此基础上从平衡移动的角度分析.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | CH3-CH2-CH2-CH2-OH | ||
| C. | CH2=CHCl | D. | 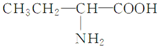 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳分子中存在共价键和分子间作用力 | |
| B. | 甲烷、氨和双氧水都是只由极性键结合而成的分子 | |
| C. | 同主族不同元素的最高价氧化物的水化物从上到下酸性递增 | |
| D. | 氟化氢的沸点高于氯化氢的沸点,水的沸点高于硫化氢的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL0.1moL/LKCl溶液 | B. | 1000mL0.1mol/LAlCl3溶液 | ||
| C. | 10mL1mol/LNaCl溶液 | D. | 1mL1mol/LMgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14C与14N含有相同的中子数 | |
| B. | 14C与C60是同分异构体 | |
| C. | 14C与C60中普通碳原子的化学性质不同 | |
| D. | 14C与12C互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com