
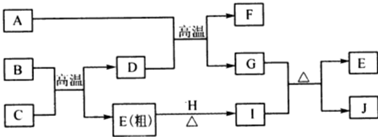
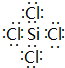 .
. 分析 B、E、G、H是单质,E是常见光太阳电池中的半导体材料,则E为Si,H呈黄绿色,应为Cl2,二者反应得到I为SiCl4,B与C反应为硅的制备,可推知B为碳、C为SiO2,D为CO,D与A反应得到F与G,A是常见液体,D、F为组成元素相同的无色气体,故A为H2O、F为CO2、G为H2,G与H(SiCl4)反应得到E(Si)与J,则J为HCl,以此解答该题.
解答 解:B、E、G、H是单质,E是常见光太阳电池中的半导体材料,则E为Si,H呈黄绿色,应为Cl2,二者反应得到I为SiCl4,B与C反应为硅的制备,可推知B为碳、C为SiO2,D为CO,D与A反应得到F与G,A是常见液体,D、F为组成元素相同的无色气体,故A为H2O、F为CO2、G为H2,G与H(SiCl4)反应得到E(Si)与J,则J为HCl,
(1)由上述分析可知,I为SiCl4,其电子式为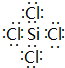 ,故答案为:
,故答案为: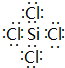 ;
;
(2)由上述分析可知,I的化学式为SiCl4,故答案为:SiCl4;
(3)B与C反应的化学方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(4)H与氢氧化钠溶液反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查无机物推断,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,物质的颜色及用途等时推断突破口,注意掌握中学常见化学工业原理.


科目:高中化学 来源: 题型:解答题
| 物质的量浓度 | N2 | H2 | NH3 |
| 起始/mol•L-1 | a | 6 | 0 |
| 转化/mol•L-1 | b | c | d |
| 平衡/mol•L-1 | 1 | e | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 银镜反应采用水浴加热 | |
| B. | 用通过盛溴水的洗气瓶的方法除去甲烷气体中含有的乙烯杂质 | |
| C. | 在乙醛还原新制Cu(OH)2悬浊液的实验中,制Cu(OH)2悬浊液时应保持NaOH过量,可直接加热 | |
| D. | 配制银氨溶液时,将AgNO3溶液滴入氨水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
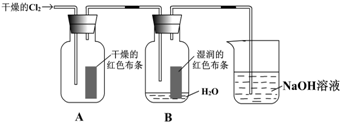
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
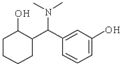 )是一种镇痛和麻醉药物,可由化合物B(
)是一种镇痛和麻醉药物,可由化合物B( )通过以下路线合成得到.
)通过以下路线合成得到.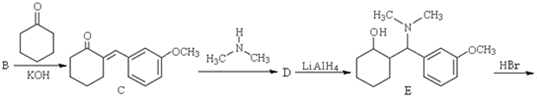
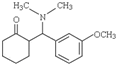 .
.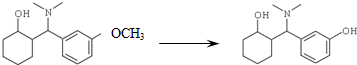 +HBr+CH3Br.
+HBr+CH3Br. 等.
等.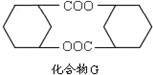 所示)的合成路线流程图(无机试剂任选).
所示)的合成路线流程图(无机试剂任选).
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
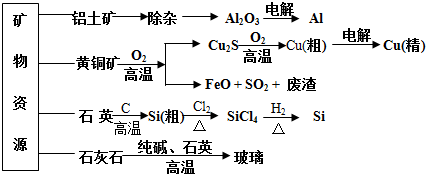
| A. | 制取玻璃的同时产生CO2气体,制取粗硅时生成的气体产物为CO | |
| B. | 黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料 | |
| C. | 粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法 | |
| D. | 生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由${\;}_{1}^{2}$H和${\;}_{8}^{18}$O所组成的11g水中所含中子数为6NA | |
| B. | H2O和D2O互称为同素异形体,且两者的化学性质相似 | |
| C. | ${\;}_{8}^{18}$O2和${\;}_{8}^{16}$O3互称为同位素 | |
| D. | 金刚石和石墨互为同素异形体,两者之间的转化属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 步骤(3)后可以确定CO32-一定不存在 | |
| B. | 忽略步骤(1)对实验结论并无影响 | |
| C. | 不能确定原溶液是否含有K+和Cl- | |
| D. | 若把步骤(2)产生的气体通入步骤(1)的滤液中,又可产生0.78g沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
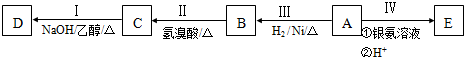
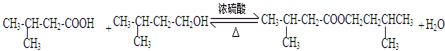 ;
;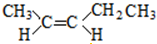 、
、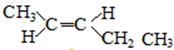 ;
; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com