
(12分)(1)氯化铁水解的离子方程式为 ,向氯化铁溶液中加入碳酸氢钠溶液,发现有红褐色沉淀生成,并产生无色气体,其离子方程式为 。
(2)向盛有1mL 0.1mol/L MgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到的现象是白色沉淀转变为红褐色沉淀。产生该现象的原因是 。
(3)25℃,向100mL pH=12的NaOH溶液加入pH=10的NaOH溶液1000 mL,混合后溶液体积1100 mL ,pH= 。
(4)常温下,将0.1000 mol L-1 NaOH溶液滴入20.00 mL 0.1000 mol L-1的一元弱酸HA溶液中,刚好完全反应,则c(Na+) c(A-)。(填“>”、“<”或“=”)
(5)某有机物结构为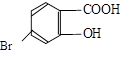 ,它的含氧官能团名称为 、 。
,它的含氧官能团名称为 、 。
 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
(12分)(1)氯化铁水解的离子方程式为 ,向氯化铁溶液中加入碳酸氢钠溶液,发现有红褐色沉淀生成,并产生无色气体,其离子方程式为 。
(2)向盛有1mL 0.1mol/L MgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到的现象是白色沉淀转变为红褐色沉淀。产生该现象的原因是 。
(3)25℃,向100mL pH=12的NaOH溶液加入pH=10的NaOH溶液1000 mL,混合后溶液体积1100 mL ,pH= 。
(4)常温下,将0.1000 mol L-1 NaOH溶液滴入20.00 mL 0.1000 mol L-1的一元弱酸HA溶液中,刚好完全反应,则c(Na+) c(A-)。(填“>”、“<”或“=”)
(5)某有机物结构为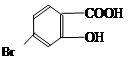 ,它的含氧官能团名称为 、 。
,它的含氧官能团名称为 、 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省盐城市高三上学期学情调研考试化学试卷(解析版) 题型:实验题
(12 分)以电石渣[主要成分是Ca(OH)2,含SiO2、Al2O3以及其它少量杂质]为原料生产氯酸钾联产碳酸钙的流程如下:
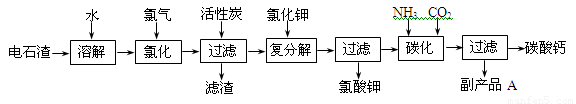
回答下列问题:
(1)电石渣溶于水形成电石渣浆时发生的主要反应的化学方程式为:
_____________________________________、__________________________________。
(2)氯化过程的温度控制在75~80℃,该过程主要反应的化学方程式为:
________________________________________________________________________。
(3)该流程中加入活性炭的作用是_____________________________________________。
(4)该流程中碳化反应的离子方程式为_________________________________________。
(5)副产品A的化学式为________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省双鸭山市高三第三次月考化学试卷(解析版) 题型:填空题
(12分) A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为 。
(2)由A、B、W三种元素组成的18电子微粒的电子式为 。
(3)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式 。常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式 。
(4)废印刷电路反上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式 。
(5)元素D的单质在一定条件下,能与A单质化合生成一种氯化物DA,熔点为800℃DA能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后成气全的体积是 (标准状况下)。
(6)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高一第一次月考化学试卷(解析版) 题型:实验题
(12分)今年5月我区举行实验技能考查,某兴趣小组的同学在帮助老师准备化学实验时,发现实验台上整齐摆放的药品中(见下图),有一试剂瓶的标签破损。为了鉴定该试剂成分,同学们做了以下探究:
【提出问题】这瓶试剂的成分是什么?
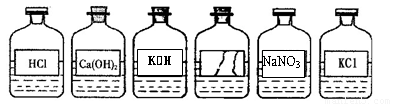
[讨论]根据受损标签及实验室药品分类摆放的原则,这瓶试剂可能不是_______________________;
A.酸 B.碱 C.盐
[猜想]①可能是NaOH溶液;②可能是Na2CO3溶液;
③可能是_______________________(写一种)。
[探究活动]
(1)小军取少量试样于小试管中,滴加酚酞试液,溶液变为红色。由此小军认为猜想①正确。
经同学们交流讨论后,一致认为小军的方案不可行,理由是_______________________
(2)小华同学认为,虽然小军的实验不能得到正确的结论,但只要再往溶液中滴加一种氯化
物溶液,同样能得出正确的结论。
|
操作步骤 |
实验现象 |
实验结论 |
|
取少量滴有酚酞试液的试样于小试管中,滴加足量的___________ |
溶液由红色褪为无色 且有白色沉淀产生 |
猜想②正确 |
(3)小亮发现要进一步确定(1)中的成分,只需选择上图已有的试剂就能把它鉴定出来。于是他们进行了如下实验。
|
操作步骤 |
实验现象 |
结论及化学方程式 |
|
取少量试样于小试管中,滴加适量的_______________________ |
_________________ _________________ |
猜想②正确 有关化学方程式 _________________ |
[实验反思]实验室盛放NaOH溶液的试剂瓶不能用玻璃塞,其原因是:NaOH与玻璃中的
SiO2发生反应,其化学方程式为2NaOH + SiO2= X + H2O,产物X使瓶口与塞子粘合在一起。
试推测X的化学式为_________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年内蒙古巴市高三上学期10月月考化学试卷 题型:实验题
1. (12分)某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2哪一个的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含________(填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含__________所致。
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。供选用的试剂:
a.酚酞试液 b.CCl4 c.无水酒精 d.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
|
|
选用试剂 |
实验现象 |
|
方案1 |
|
|
|
方案2 |
|
|
(4)应用与拓展
①在足量的稀氯化亚铁溶液中加入1~2滴溴水,溶液呈黄色,所发生的离子反应方程式为
_______________________________________________________________________。
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/3的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com