
| 化学式 | CO(g) | H2(g) | CH3OH(l) | CH4(g) |
| △H/(kJ/mol) | -283.0 | -285.8 | -726.5 | -890.3 |
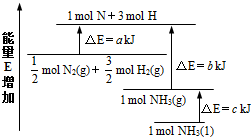
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
 2NH3,由N2和H2合成1molNH3时可放出46.2kJ/mol的热量,则反应的△H=-2×46.2=-92.4kJ/mol,
2NH3,由N2和H2合成1molNH3时可放出46.2kJ/mol的热量,则反应的△H=-2×46.2=-92.4kJ/mol,| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 112L |
| 22.4L/mol |
| 1 |
| 2 |


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.当△H<0时,表示该反应为吸热反应 | ||
B.已知C(s)+
| ||
| C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 | ||
| D.化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Ex<Ez+Ew | B.Ey>Ez+Ew |
| C.Ex+EY>Ez+Ew | D.Ex+Ey<Ez+Ew |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=-114.6kJ/mol |
| B.CO(g)的燃烧热是283.0kJ/mol,则相同条件下2CO2(g)=2CO(g)+O2(g)的△H=+566.0kJ/mol |
| C.熵增(△s>0)的反应常温下一定能自发进行 |
| D.已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学变化过程是原子的重新组合过程 |
| B.化学反应中能量变化多少与其反应物用量有关 |
| C.一个化学反应,当反应物能量大于生成物能量时,反应放热 |
| D.化学反应中的能量变化都是以热量形式表现出来 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定温度压强下,△H<0、△S>0的反应一定能自发进行 |
| B.铅蓄电池放电时的负极和充电时的阴极均发生还原反应 |
| C.为保护浸入海水中的钢闸门,可将闸门连接到直流电源的正极上 |
| D.一定温度下,反应:2A(g)+B(g)?2C(g),增大压强反应速率加快,A的浓度减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com