
 25℃时,用0.1000mol•L-1的NaOH溶液滴定20mL 0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示,下列说法不正确的是( )
25℃时,用0.1000mol•L-1的NaOH溶液滴定20mL 0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示,下列说法不正确的是( )| A. | 可用酚酞作该滴定的指示剂 | |
| B. | 当溶液中c(H+)+c(OH-)=2×10-7时,c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 当滴定到pH=4.75时,c(A-)>c(Na+)>c(HA) | |
| D. | 当滴入40mL NaOH溶液时,溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) |
分析 A、依据0.1000mol•L-1一元酸HA溶液反应终点溶液呈碱性,酚酞变色范围8-10可以选择酚酞做指示剂;
B、当溶液中c(H+)+c(OH-)=2×10-7时溶液呈中性;
C、当滴定到pH=4.75时,滴入10ml氢氧化钠溶液,发生反应后的溶液中为等浓度的NaA和HA,溶液显酸性,HA酸电离大于A-离子水解;
D、当滴入40mL NaOH溶液时,得到等浓度的NaA和NaOH,溶液中c(A-)<c(OH-).
解答 解:A、依据0.1000mol•L-1一元酸HA溶液反应终点溶液呈碱性,酚酞变色范围8-10可以选择酚酞做指示剂,故A正确;
B、当溶液中c(H+)+c(OH-)=2×10-7时,溶液呈中性,c(Na+)=c(A-)>c(OH-)=c(H+),故B正确;
C、当滴定到pH=4.75时,滴入10ml氢氧化钠溶液,发生反应后的溶液中为等浓度的NaA和HA,溶液显酸性,HA弱酸电离大于A-离子水解,溶液中离子浓度大小c(A-)>c(Na+)>c(HA),故C正确;
D、当滴入40mL NaOH溶液时,得到等浓度的NaA和NaOH,溶液中c(A-)<c(OH-),c(Na+)>c(OH-)>c(A-)>c(H+),故D错误;
故选D.
点评 本题考查了图象分析方法,酸碱中和反应后溶液酸碱性的判断,溶液中电荷守恒和离子浓度大小比较是解题关键,题目难度中等.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 三种溶液中,相关微粒存在如下关系:c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ) | |
| B. | 三种溶液中离子浓度c(X-)<c(Y-)<c(Z-) | |
| C. | 将三种溶液均加水稀释到1000mL后,三种溶液的pH分别为8、9、10 | |
| D. | HX、HY、HZ的酸性依次增强,电离平衡常数K(HX)>K(HY)>K(HZ) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ${\;}_{\;}^{37}$Cl2的摩尔质量是74 | |
| B. | 通常情况下,氯气做氧化剂,但氯气也具有还原性 | |
| C. | 35克的${\;}_{\;}^{35}$Cl2含有电子17mol | |
| D. | 常温下,4.48L ${\;}_{\;}^{37}$Cl2含有8NA 个中子(NA 为阿伏加德罗常数) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
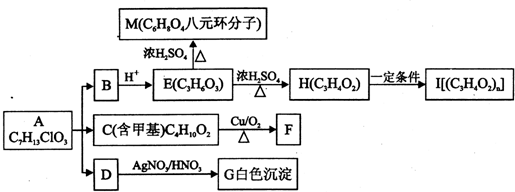
 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$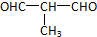 +2H2O.
+2H2O.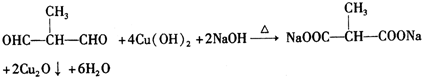 .
.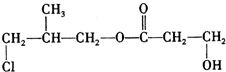
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
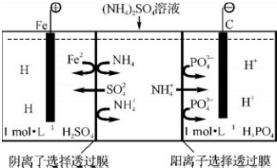
| A. | 阳极室溶液由无色变成棕黄色 | |
| B. | 阴极的电极反应式为:4OH--4e═2H2O+O2↑ | |
| C. | 电解一段时间后,阴极室溶液中的pH升高 | |
| D. | 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.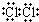 .新制的氯水可用于漂白,工业上将氯气制成漂白粉的目的是漂白粉比次氯酸稳定,便于储存和运输,漂白粉是一种混合物(填“混合物”或“纯净物”)
.新制的氯水可用于漂白,工业上将氯气制成漂白粉的目的是漂白粉比次氯酸稳定,便于储存和运输,漂白粉是一种混合物(填“混合物”或“纯净物”)查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 ⑥-C6H5 ⑦Br-⑧-COOH ⑨-CH3其中不是官能团的是( )
⑥-C6H5 ⑦Br-⑧-COOH ⑨-CH3其中不是官能团的是( )| A. | ①③④⑥⑧ | B. | ②④⑥⑦⑨ | C. | ②③⑤⑦⑧ | D. | ①③⑤⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com