
����Ŀ��������������������ڽ�������Ӧ���Ʊ�SnCl4��ij��ѧС���ͬѧ���������ʵ��װ�ý����Ʊ���
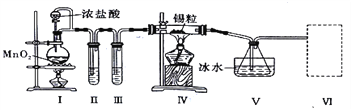
��֪���ٽ������۵�Ϊ231�棬��ѧ�������������ƣ���SnCl4�ķе�Ϊ114�棻��SnCl4����ˮ��Ӧ��
�������ͼװ�ûش�:
��1���Թ�II�е��Լ���________���Թ�III�е��Լ���____________��
��2��װ��V��������____________��
��3���b�â� ���ѡ������װ���е�________(����)��
��4��ʵ�����������������װ�â���δ��Ӧ���MnO2����Ҫ�IJ���������_________��
���𰸡� ����ʳ��ˮ Ũ���� ����(�ռ�)SnCl4 C ©�������������ձ�
����������1�����ɵ������к����Ȼ����ˮ���������ȳ�ȥ�Ȼ��⣬���ñ���ʳ��ˮ��Ȼ������Ũ����������������Թ�II�е��Լ��DZ���ʳ��ˮ���Թ�III�е��Լ���Ũ���ᡣ��2��SnCl4�ķе�Ϊ114�棬���װ��V������������(�ռ�)SnCl4����3�������ж�����Ҫβ������������SnCl4����ˮ��Ӧ����Ҫ��ֹ�����е�ˮ�������룬�����b�â����Լ����ѡ�ü�ʯ�ң���ѡC����4���������̲�����ˮ��ʵ�����������������װ�â���δ��Ӧ���MnO2����Ҫ���ˣ���Ҫ�IJ���������©�������������ձ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȷ£�CHCl3���ǵ���ʣ��ڿ������ܷ����������������ɾ綾���ʹ�����COCl2���ǵ���ʣ�����ѧ����ʽΪ2CHCl3+O2=2COCl2+2HCl�������ȷ��Ƿ�����Ӧѡ�õ��Լ��ǣ� ��
A��ˮ B��NaOH��Һ
C����̪��Һ D�������ữ����������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʹ�õĽ���֮һ��������ѧ֪ʶ���ش��������⡣
��1����FeCl3��Һ�����ˮ�����Ƶ�Fe(OH)3���塣����Fe(OH)3�����FeCl3��Һ�ķ�����____________________________________��
��2������������������ɢϵ�ı���������__________________________________��
��3�����岻�����������������Գ���������������ȱ����ƶѪ�����Ͳ�����ͬʱ����ά����C��ԭ��__________________________________________________��
��4�����ӹ�ҵ��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ������ӡˢ��·�壬��д��FeCl3��Һ��ͭ��Ӧ�����ӷ���ʽ__________________________________________��
����ʦ��������ӡˢ��·��ķ�ˮ�л���ͭ�������FeCl3��Һ��������·�����
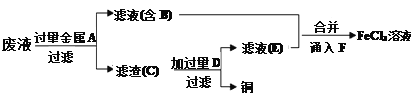
����������Ʒ����������ѧ֪ʶ�ش��������⡣
��5��������ҺE�н��������ӵķ�����___________________________________��
��6��ͨ��F������Ӧ�����ӷ���ʽΪ_____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е����ӣ�������Һ�д����������
A. K+��Cu2+��Cl����OH�� B. Mg2+��SO42����K+��Cl��
C. Na+��H+��NO3����CO32�� D. Ba2����Na+��OH����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. ͬ��ͬѹ�£���ͬ����������ʣ����ǵ����ʵ��������
B. �κ������£������ʵ����ĵ�����һ����̼�����ķ����������
C. 1Lһ����̼���������һ����1L����������ҪС
D. ������������ʵ���Ũ�ȵ�ǿ����������H+��һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʵ�ȼ������ȵ��ǣ�������
A.̼�Ͷ�����̼
B.1mol̼��3mol̼
C.3mol��Ȳ��C2H2����1mol��
D.���ۺ���ά��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�������˵����ȷ���ǣ� ��
A.���ͼױ�����ʹ���Ը��������Һ��ɫ
B.CH2=C(CH3)-CH=CH2������ʵ������巴Ӧ�������2��
C.����ʽΪC8H10�����ڷ�������ͬ���칹����3��
D.�����������顢��ϩ��ȫȼ��������������ǰ�߶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������뽫̼���ͨ������ļӹ�����ʹ֮��Ϊ����̼�����̼�������ֱ���Ǽ���������ʮ���������⽫���������ϵ����ܷ����ޱ䡣���й�������̼��Ƶ��Ʋ���ܵ��������� ��
A. ����̼��Ƶ�ˮ��Һ����Dz���
B. ����̼��Ʒ�ɢ��ˮ���ܲ��������ЧӦ
C. ����̼��ƻ�ѧ��������ԭ��̼�����ȫ��ͬ
D. ����̼��Ƶ����Ӳ�������ֽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ����Ҫ�����ȼ�ϣ�Ҳ�������������������ȣ��Գ��������ƻ����á���ҵ�Ͽ�����ú���������ˮú�����ϳɶ����ѡ�
��ش��������⣺
��1��ú����������Ҫ��ѧ��Ӧ����ʽΪ��___________________________��
��2��ú�����������в������к�����H2S��Na2CO3��Һ���գ�����������ʽ�Σ��÷�Ӧ�Ļ�ѧ����ʽΪ��________________________________________��
��3������ˮú���ϳɶ����ѵ�������Ӧ���£�
�� 2H2(g) + CO(g) ![]() CH3OH(g)����H �� ��90.8 kJ��mol��1
CH3OH(g)����H �� ��90.8 kJ��mol��1
�� 2CH3OH(g) ![]() CH3OCH3(g) + H2O(g)����H�� ��23.5 kJ��mol��1
CH3OCH3(g) + H2O(g)����H�� ��23.5 kJ��mol��1
�� CO(g) + H2O(g) ![]() CO2(g) + H2(g)����H�� ��41.3 kJ��mol��1
CO2(g) + H2(g)����H�� ��41.3 kJ��mol��1
�ܷ�Ӧ��3H2(g) + 3CO(g) ![]() CH3OCH3(g) + CO2 (g)����H�� ___________��
CH3OCH3(g) + CO2 (g)����H�� ___________��
һ�������µ��ܱ������У����ܷ�Ӧ�ﵽƽ�⣬Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ��__________������ĸ���ţ�
a�����¸�ѹ b��������� c������CO2��Ũ��
d������CO��Ũ�� e�������������
��4����֪��Ӧ��2CH3OH(g) ![]() CH3OCH3(g) + H2O(g)ij�¶��µ�ƽ�ⳣ��Ϊ400 �����¶��£����ܱ������м���CH3OH ����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
CH3OCH3(g) + H2O(g)ij�¶��µ�ƽ�ⳣ��Ϊ400 �����¶��£����ܱ������м���CH3OH ����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
���� | CH3OH | CH3OCH3 | H2O |
Ũ��/��mol��L��1�� | 0.44 | 0.6 | 0.6 |
�� �Ƚϴ�ʱ�����淴Ӧ���ʵĴ�С��v�� ______ v�� ������>������<����������)��
�� ������CH3OH��10 min��Ӧ�ﵽƽ�⣬��ʱc(CH3OH) �� _________����ʱ���ڷ�Ӧ����v(CH3OH) �� __________���ﵽƽ��ʱ�״���ת��������CH3OH��= _________
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com