
【题目】温度为T时,向2L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)![]() C(g)+xD(g) ΔH>0,容器中A、B、D的物质的量随时间的变化如图所示。下列说法正确的是( )
C(g)+xD(g) ΔH>0,容器中A、B、D的物质的量随时间的变化如图所示。下列说法正确的是( )

A.反应前10min内反应的平均速率为v(D)=0.3mol·L-1·min-1
B.反应至15min时,其他条件不变,改变的条件可能是缩小容器体积
C.若平衡时保持温度不变,压缩容器体积,平衡逆向移动,平衡常数K值减小
D.反应至15min时,其他条件不变,改变的条件可能是降低反应体系温度
【答案】BD
【解析】
由图可知,平衡时A、D的物质的量变化量分别为1.5mol、3mol,故△n(A)∶△n(D)=1∶x=1.5∶3,所以x=2,该反应为气体体积增大的反应,△H>0,正反应为吸热反应,据此分析解答。
A.由图象可知,10min时反应到达平衡,平衡时D的物质的量变化量为3mol,故v(D)=![]() =
=![]() =0.15molL-1min-1,故A错误;
=0.15molL-1min-1,故A错误;
B.由图可知,反应至15 min时,改变条件瞬间,D的物质的量减小,A、B的物质的量增大,说明平衡向逆反应方向移动,根据上述分析,x=2,反应后气体的体积增大,缩小容器体积,压强增大,平衡逆向移动,因此改变的条件可能是缩小容器体积,故B正确;
C.平衡常数K只与温度有关,温度不变,K不变,故C错误;
D.由图可知,反应至15 min时,改变条件瞬间,D的物质的量减小,A、B的物质的量增大,说明平衡向逆反应方向移动,该反应的正反应为吸热反应,降低温度,平衡逆向移动,因此改变条件可能是降低温度,故D正确;
故选BD。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中由水电离的氢离子浓度为1×10-5的是 ( )
A.pH=5的HClO 溶液B.pH=9的氨水
C.pH=5的AlCl3溶液D.pH=5的NaHSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用下图装置(夹持仪器已省略)制备溴苯,并探究该反应原理。
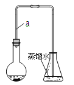
I.制备溴苯
(1)装置中长导管a的作用是______、导出气体,制备溴苯的反应方程式属于______反应,其方程式为________
(2)本实验所获得的溴苯为褐色,是因为________________。
II.分离提纯
已知,溴苯与苯互溶,液溴、苯、溴苯的沸点依次为59℃、80℃、156℃。同学们设计了如下流程:
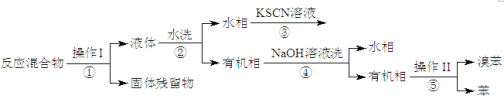
(3)操作Ⅱ为_____________。
(4)流程②和④中,需要用到的玻璃仪器是烧杯、_______;流程③的现象为______,流程④的作用是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化石燃料开采、加工过程产生的H2S 废气制取氢气,既价廉又环保。
(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气。
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为____________;
②常温下,不能与M单质发生反应的是____________(填序号);
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气制取氢气的方法有多种。
①高温热分解法已知:H2S(g)![]() H2(g)+1/2S2(g)
H2(g)+1/2S2(g)
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见图。曲线a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。根据图像回答下列问题:
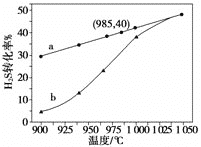
i 计算 985 ℃时H2S按上述反应分解的平衡常数 K=________;
ii 说明随温度的升高,曲线b向曲线a逼近的原因:________________________________;
②电化学法
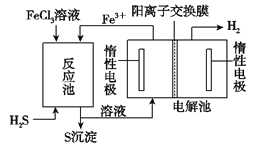
i该法制氢过程如图。反应池中反应物的流向采用气、液逆流方式,其目的是____________;
ii反应池中发生反应的化学方程式为____________;
iii反应后的溶液进入电解池,电解总反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中,有反应mA(g)+nB(g)![]() pC(g)+qD(g),经过5 min达到平衡,此时各物质的变化为A物质的量浓度减少amol·L-1,B的平均反应速率v(B)=a/15 mol·L-1·min-1,C物质的量浓度增加2a/3 mol·L-1,这时若增大系统压强,发现A与C的百分含量不变,则m∶n∶p∶q为( )
pC(g)+qD(g),经过5 min达到平衡,此时各物质的变化为A物质的量浓度减少amol·L-1,B的平均反应速率v(B)=a/15 mol·L-1·min-1,C物质的量浓度增加2a/3 mol·L-1,这时若增大系统压强,发现A与C的百分含量不变,则m∶n∶p∶q为( )
A.3∶1∶2∶2B.1∶3∶2∶2C.3∶1∶2∶1D.1∶1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是
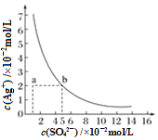
A. 含有大量SO42-的溶液中肯定不存在Ag+
B. Ag2SO4的溶度积常数(Ksp)为1×10-3
C. 0.02 mol·L-1的AgNO3溶液与0.02 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
D. a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4 + 5H2C2O4 + 3H2SO4 = K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05mol/L KMnO4溶液 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是___________________________________。
(2)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)= ________。
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
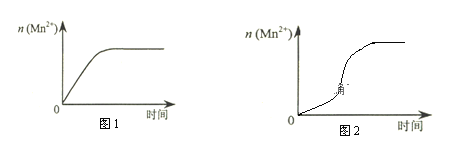
①该小组同学提出的假设是___________________________________________________。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L稀硫酸 | 0.05mol/L KMnO4溶液 | |||
4 | 3.0 | 2.0 | 2.0 | 3.0 | _______ | t |
③若该小组同学提出的假设成立,应观察到的现象是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容密闭容器中充满NO2,常温下建立下列平衡:2NO2(g)![]() N2O4(g)ΔH < 0,将容器置于100 ℃的水浴中,则下列性质不改变的是
N2O4(g)ΔH < 0,将容器置于100 ℃的水浴中,则下列性质不改变的是
A.颜色B.压强C.质量D.平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的个数是
①含氧的化合物一定是氧化物
②盐的组成中一定含有金属元素
③![]() 一元酸溶液中
一元酸溶液中![]() 浓度一定为
浓度一定为![]()
④强酸溶液中的![]() 浓度一定大于弱酸溶液中的
浓度一定大于弱酸溶液中的![]() 浓度
浓度
⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子
⑥![]() 水溶液电离时生成的阳离子有氢离子,所以是酸
水溶液电离时生成的阳离子有氢离子,所以是酸
A.1个B.2个C.3个D.4个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com