
| A. | 用20mL量筒量取15mL酒精,加水5mL,配制质量分数为75%的酒精溶液 | |
| B. | 在200mL某硫酸盐溶液中,含有1.5NA个硫酸根离子,同时含有NA个金属离子,则该硫酸盐的物质的量浓度为0.5mol/L | |
| C. | 实验中需用2.0mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分数分别为950mL、201.4g | |
| D. | 实验室配制500mL 0.2mol/L的硫酸亚铁溶液,其操作是:用天平称15.2g绿矾(FeSO4•7H2O),放入小烧杯中加水溶解,转移到500mL容量瓶、稀释、定量、摇匀 |
分析 A.量筒不能用来配制溶液;
B.1.5NA个硫酸根离子的物质的量为1.5mol,NA个金属阳离子的物质的量为1mol,根据电荷守恒可知,金属阳离子为+3价,所以该硫酸盐可以表示为M2(SO4)3,根据硫酸根守恒可知,硫酸盐为0.5mol;
C.由于容量瓶没有950mL规格,应用1000mL的容量瓶进行配制,然后根据m=cVM进行计算;
D.配制一定物质的量浓度溶液的步骤为:计算、称量、溶解、转移、洗涤、定容、摇匀等.
解答 解:A.量筒不能用来配制溶液,应用烧杯配制,故A错误;
B.1.5NA个硫酸根离子的物质的量为1.5mol,NA个金属阳离子的物质的量为1mol,令金属离子的化合价为x,根据电荷守恒可知,x=1.5×2=3,故金属阳离子为+3价,所以该硫酸盐可以表示为M2(SO4)3,根据硫酸根守恒可知,硫酸盐为0.5mol,所以该硫酸盐的物质的量浓度为$\frac{0.5mol}{0.2L}$=2.5mol/L,故B错误;
C.容量瓶没有950mL规格,应用1000mL的容量瓶进行配制,则m(Na2CO3)=cVM=1L×2mol/L×106g/mol=212g,故C错误;
D.500mL 0.2mol/L的硫酸亚铁溶液含硫酸亚铁0.1mol,15.2g绿矾(FeSO4•7H2O)的物质的量为0.1mol,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及溶液配制,物质的量浓度的计算等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液呈碱性,可用于洗去铁屑表面的油污 | |
| B. | 浓硫酸具有强氧化性,可用于与亚硫酸钠反应制取二氧化硫 | |
| C. | 氢氧化铝能表现弱酸性,可用于制抗酸药品 | |
| D. | 铜的金属活动性比铁的弱,可在海轮外壳上装若干铜块以减缓船体腐蚀速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
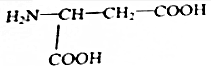 (5)
(5)
| A. | 二肽 | B. | 三肽 | C. | 四肽 | D. | 五肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gH2O含有10NA个质子 | |
| B. | 2L 0.5mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 常温常压下,8g O2含有4NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com