
 25℃时,向20ml浓度为0.lmol/L的CH3COOH溶液中逐滴加入0.lmol/L的NaOH溶液,溶液pH的变化如图所示,下列说法不正确的是( )
25℃时,向20ml浓度为0.lmol/L的CH3COOH溶液中逐滴加入0.lmol/L的NaOH溶液,溶液pH的变化如图所示,下列说法不正确的是( )| A. | c点时,c(Na+)=c(CH3COO-) | |
| B. | b点时,c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | d点时,c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 从a点到c点间可能有:c(CH3COO-)>c(H+)=c(Na+)>c(OH-) |
分析 A、醋酸和氢氧化钠反应生成醋酸钠,c点溶液呈中性,根据电荷守恒来回答;
B、b点时,得到的溶液是醋酸和醋酸钠的混合物,溶液显示酸性;
C、d点时,醋酸和醋酸钠恰好完全反应,得到的是醋酸钠的混合物,显示碱性;
D、从a点到c点间是醋酸的量逐渐增加,知道反应完成后醋酸剩余的过程.
解答 解:A、醋酸和氢氧化钠反应生成醋酸钠,c点溶液呈中性c(H+)=c(OH-),根据电荷守恒,(Na+)=c(CH3COO-),故A正确;
B、b点时,得到的溶液是醋酸和醋酸钠的混合物,溶液显示酸性,c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B错误;
C、d点时,醋酸和醋酸钠恰好完全反应,得到的是醋酸钠的混合物,显示碱性,此时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C正确;
D、从a点到c点间是醋酸的量逐渐增加,直到c点,反应完成后醋酸剩余溶液显示中性的过程,可以存在:c(CH3COO-)>c(H+)=c(Na+)>c(OH-),故D正确.
故选B.
点评 本题考查酸碱滴定过程中溶液酸碱性的判断以及离子浓度大小比较知识,注意盐的水解原理的应用是重点,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:NH4+、Fe2+、SO42-、Cl- | |
| B. | 能使酚酞试液变红的溶液:Na+、K+、HCO3-、S2- | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液中:Na+、I-、SCN-、SO42- | |
| D. | 由水电离出的c(H+)=1.0×10-13 mol•L-1的溶液中:Na+、HCO3-、Cl-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
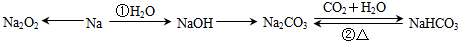
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
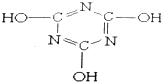
| A. | 分子式为C3H3N303 | B. | 属于共价化合物 | ||
| C. | 分子中只含极性键,不含非极性键 | D. | 该分子中的C原子采取sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸干AlCl3溶液可得AlCl3固体 | |
| B. | 向FeCl3溶液中加少量盐酸,抑制Fe3+水解 | |
| C. | 用纯碱溶液清洗油污时,加热可以增强其去污力 | |
| D. | 除去MgCI2酸性溶液中的Fe3+,可在加热搅拌的条件下加入MgCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
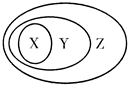
| A. | X是氧化物Y是化合物Z是纯净物 | |
| B. | X是非金属单质Y是非电解质Z是纯净物 | |
| C. | X是金属氧化物Y是碱性氧化物Z氧化物是 | |
| D. | X是置换反应Y是氧化还原反应Z是离子反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
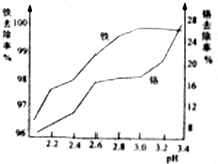 碱式硫酸铬可用于皮革、印染等行业.
碱式硫酸铬可用于皮革、印染等行业.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com