

| ||
| 0.01mol |
| 0.1L |
| Kw |
| c(OH-) |
| 10-14 |
| 0.1 |


 ��ְٷְټ���ϵ�д�
��ְٷְټ���ϵ�д� �����ƻ���ĩ��̶�100��ϵ�д�
�����ƻ���ĩ��̶�100��ϵ�д� �ܿ���ȫ��100��ϵ�д�
�ܿ���ȫ��100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������軯����Һ���Լ�����Һ�е�Fe3+��Fe3++3SCN-=Fe��SCN��3�� |
| B����˫��ˮ��ϡ������Ե��ӡˢ��·�壺Cu+H2O2+2H+=Cu++2H2O |
| C��KI��Һ��H2SO4�ữ��H2O2��Һ��ϣ�2I-+H2O2+2H+=2H2O+I2 |
| D������ʯ��ˮ������մ���Һ��ϣ�Ca2++OH-+HCO3-=CaCO3��+H2O�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��CH4�� C2H4 |
| B��CH3OH CH3COOH |
| C��C2H6 HCHO |
| D��HCHO CH3COOCH3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
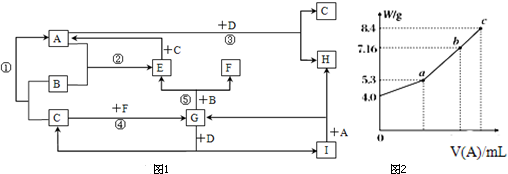
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ƺ�п | B��þ��ͭ |
| C������þ | D��п���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��N2��CO |
| B��H2��CO |
| C��CH4 |
| D��H2��CH4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����Һ��Cu2+�������ƶ���Cl-�������ƶ� |
| B�������Ϸ�����ԭ��Ӧ�������Ϸ���������Ӧ |
| C��������Ӧ��Cu2++2e-=Cu |
| D��������ʪ���KI������ֽ����������������ΪCl2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ijѧϰС�����Ҵ���������Ϊԭ���Ʊ������飮�÷�Ӧ������ԭ��Ϊ��C2H5OH+HBr
ijѧϰС�����Ҵ���������Ϊԭ���Ʊ������飮�÷�Ӧ������ԭ��Ϊ��C2H5OH+HBr| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ������I��eV�� | A | B | C | D | E |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 153.7 |

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com