
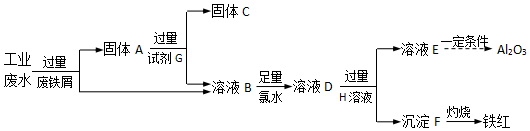
分析 由流程可知,某工厂排放的工业废水中含Fe3+、Al3+、Cu2+,先加过量铁2Fe3++Fe═3Fe2+,铁在金属活动顺序表中排在铜的前面,所以铁粉把铜置换出来,发生Fe+Cu2+═Cu+2Fe2+,由于铁过量,可知固体A中含Fe和Cu;试剂G为盐酸,Cu与盐酸不反应,则固体C为Cu,溶液B中含Fe3+、Al3+、Fe2+,加氯水,+2价的铁离子被氯水氧化,2Fe2++Cl2=2Fe3++2Cl-;再加过量D为NaOH,溶液E为偏铝酸钠,沉淀F为Fe(OH)3,以此来解答.
解答 解:(1)根据流程图中可以知道,完成回收铁红、Al2O3和金属Cu,先加过量铁粉,2Fe3++Fe═3 Fe2+,铁在金属活动顺序表中排在铜的前面,所以铁粉把铜置换出来,Cu2++Fe=Fe2++Cu,过滤得到Fe、Cu,
故答案为:Fe、Cu;
(2)金属铁可以和铁离子、铜离子之间反应,过滤所得溶液B中含有Al3+、Fe2+,故答案为:Fe3+、Al3+、Fe2+;
(3)B→D反应的离子方程式是2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(4)由上述分析可知,G为盐酸,故答案为:盐酸;
(5)分离Al3+、Fe2+,需加强碱,氢氧化铝既可以和强酸反应还可以和强碱反应,溶液E焰色反应呈黄色说明含有钠离子,说明试剂H是氢氧化钠,
故答案为:NaOH.
点评 本题考查物质的制备,为高考常见题型,侧重于学生的分析与实验能力的考查,把握流程中的反应及混合物分离方法为解答该类题目的关键,题目难度不大.


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{m}{23V}$mol/L | B. | $\frac{23}{mV}$mol/L | C. | $\frac{2m}{23V}$mol/L | D. | $\frac{m}{46V}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HS-)>c(K+)>c(S2-)>c(OH-)>c(H-) | B. | c(H+)>c(OH-) | ||
| C. | 2c(K+)+c(H+)═c(HS-)+2c(S2-) | D. | c(OH-)+c(S2-)=c(H+)+c(HS-)+2c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:
某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 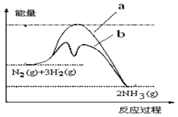 图中曲线b表示工业合成氨中加入铁触媒(催化剂)的能量变化曲线 | |
| B. | 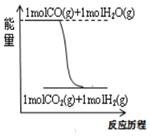 根据图可知在该条件下:CO2(g)+H2(g)═CO(g)+H2O(g)△H<0 | |
| C. |  图中曲线表示向1.0 mol•L-1的醋酸溶液中通入氨气,溶液导电能力的变化情况 | |
| D. |  图中曲线表示常温下向弱酸HA的稀溶液中加水稀释时,c(HA)/c(A-)的变化情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 10 | C. | 104 | D. | 10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(Y)<r(Z) | |
| B. | X和Z都只能形成一种氧化物 | |
| C. | W的最高价氧化物对应的水化物是强酸 | |
| D. | Y的简单气态氢化物的热稳定性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不溶物一定是铜 | B. | 不溶物一定是铁 | ||
| C. | 不溶物中一定含铜,但不一定含铁 | D. | 滤液中可能含有CuSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com