


科目:高中化学 来源: 题型:
| A、H2O分子和NH3分子具有相同数目的质子总数,故属于同种元素 | ||
| B、18O和16O互为同位素 | ||
| C、H218O和H216O属于同素异形体 | ||
D、对人体有害的氡的放射性同位素
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
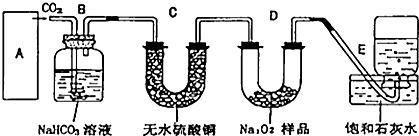

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含NO3-,Fe3+,无I-,可能有Cl- |
| B、含I-,不含NO3-,Fe3+,可能有Cl- |
| C、含I-,Fe3+,不含NO3-,可能有Cl- |
| D、含NO3-,不含I-,Fe3+,可能有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯碱工业中通常使用阳离子交换膜将电解池的阳极区与阴极区隔开 | ||||
| B、合成氨工业中,将NH3不断液化分离有利于加快反应速率 | ||||
| C、在铜质餐具上镀银时,应将餐具与电源的正极相连 | ||||
D、高炉炼铁的主要反应为:Fe2O3+3CO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
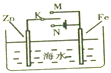 | 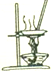 |  |  |
| 将开关K置于M或N处以减缓铁的腐蚀 | 蒸干NH4Cl饱和溶液以制备NH4Cl晶体 | 证明Ag+的氧化性强于Cu2+ | 干燥、收集并吸收多余的NH3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、实验Ⅰ:除去Cl2中混有的HCl气体 |
| B、实验Ⅱ:溶液颜色变红 |
| C、实验Ⅲ:放出大量气体 |
| D、实验Ⅳ:先出现白色沉淀,后溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com