
【题目】NOx、SO2的处理转化对环境保护有着重要意义。
(1)利用反应2NO(g)+2CO(g) = N2(g)+2CO2(g),可实现汽车尾气的无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比m[m=![]() ]的关系如图1所示。
]的关系如图1所示。
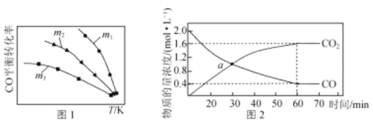
①该反应的ΔH ____0(填“>”“<”或“=”)。
②下列说法正确的是________(填字母)。
A.当体系中CO2和CO物质的量浓度之比保持不变时,反应达到平衡状态
B.投料比:m1>m2>m3
C.当投料比m=2时,NO转化率是CO转化率的2倍
D.汽车排气管中的催化剂可提高NO的平衡转化率
③随着温度的升高,不同投料比下CO的平衡转化率趋于相近的原因为________。
(2)若反应2NO(g)+2CO(g) = N2(g)+2CO2(g)的正、逆反应速率可表示为:v正=k正·c2(NO) ·c2(CO);v逆=k逆·c (N2) ·c2(CO2), k正、k逆分别为正、逆反应速率常数, 仅与温度有关。一定温度下,在体积为1L的容器中加入2molNO和2molCO发生上述反应,测得CO和CO2物质的量浓度随时间的变化如图2所示,则a点时v正∶v逆=________。
(3)工业生产排放的烟气中同时存在SO2、NOx和CO,利用它们的相互作用可将SO2、NOx还原成无害物质,一定条件下得到以下实验结果。图3为298K各气体分压(气体的物质的量分数与总压的乘积)与CO物质的量分数的关系,图4为CO物质的量分数为2.0%时,各气体分压与温度的关系。
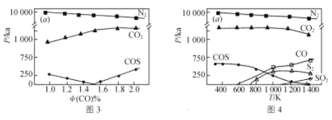
下列说法不正确的是________(填字母)。
A.不同温度下脱硝的产物为N2,脱硫的产物可能有多种
B.温度越高脱硫脱硝的效果越好
C.NOx比SO2更易被CO还原
D.体系中可能发生反应:2COS = S2+2CO;4CO2+S2 = 4CO+2SO2
(4)NH3催化还原氮氧化物是目前应用最广泛的烟气脱硝技术。用活化后的V2O5作催化剂,NH3将NO还原成N2的一种反应历程如图5所示,则总反应方程式为________。

(5)用间接电化学法去除烟气中NO的原理如图6所示,则阴极的电极反应式为____。
【答案】< AB 温度较高时,温度变化对平衡移动的影响大于浓度变化对平衡移动的影响 160:1 B 4NH3+4NO+O2![]() 4N2+6H2O 2SO32-+4H++2e-=S2O42-+2H2O
4N2+6H2O 2SO32-+4H++2e-=S2O42-+2H2O
【解析】
(1)①由图象可知,起始投料比m一定时,CO的平衡转化率随温度的升高而降低;
②A.起始投料比m一定时,而反应中NO、CO的变化量相同,体系中CO2和CO物质的量浓度之比保持不变,即体系中CO2、CO物质的量浓度不变,据此判断;
B.由图象可知,温度一定时,增大NO浓度,CO转化率增大;
C.根据转化率α=变化量与起始量的比值和反应中NO、CO的变化量相同分析判断;
D.催化剂不能改变反应进程,只改变反应速率;
③由图象可知,不同投料比下CO的平衡转化率趋于相近,主要原因是温度的影响起主导作用,投料比不同的影响为次要因素;
(2)反应达到平衡时v正=k正c2(NO)c2(CO)=v逆=k逆c(N2)c2(CO2),则平衡常数K= ![]() ,结合反应三段式计算平衡常数K和a点时各物质的浓度,代入v正、v逆计算v正:v逆;
,结合反应三段式计算平衡常数K和a点时各物质的浓度,代入v正、v逆计算v正:v逆;
(3)A.由图可知,NOx还原成无害物质为氮气,脱硫的产物可能有多种,与温度有关; B.温度高于1000℃时二氧化硫的含量增大,说明温度越高不利于脱硫;
C.根据图3,随CO物质的量分数增大,还原NOx生成氮气曲线斜率变化比较小,而还原SO2需要CO物质的量分数较大时才能将SO2从烟气中分离;
D.根据图4,COS分压曲线随温度升高减小,S2、CO分压增大,继续升高温度,S2、CO2分压减小,CO分压增大;
(4)用活化后的V2O5作催化剂,NH3将NO 还原成N2,同时生成水,原子守恒配平书写化学方程式;
(5) 阴极通入的SO32-发生得电子的还原反应生成S2O42-。
(1)①由图象可知,起始投料比m一定时,温度越高,CO的平衡转化率越低,即升高温度平衡逆向移动,所以正反应放热,即△H<0;
②A.反应正向进行时CO2增多而CO减少,说明未达到平衡时二者比值会变,所以体系中CO2和CO物质的量浓度之比保持不变,反应达到平衡状态,故A正确;
B.由图象可知,温度一定时,增大NO浓度,CO转化率增大,即起始投料比m越大时,CO转化率越大,所以投料比:m1>m2>m3,故B正确;
C.由反应计量关系可知,反应中NO、CO的变化量相同,平衡转化率α=![]() ×100%,所以平衡转化率与起始量成反比,即投料比m=2时CO转化率是NO转化率的2倍,故C错误;
×100%,所以平衡转化率与起始量成反比,即投料比m=2时CO转化率是NO转化率的2倍,故C错误;
D.催化剂不能改变反应进程,只改变反应速率,所以NO的平衡转化率不变,故D错误;
故答案为:AB;
③由图象可知,不同投料比下CO的平衡转化率趋于相近,随温度逐渐升高,温度的影响起主导作用,即温度较高时,温度变化对平衡移动的影响大于浓度变化对平衡移动的影响;
(2)平衡时三段式为:

平衡时正逆反应速率相等即k正c2(NO)c2(CO)= k逆c(N2)c2(CO2),所以![]() =80;
=80;
a点时反应三段式为:
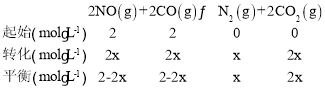
a点时c(CO)=c(CO2),则2-2x=2x,解得x=0.5,所以a点时c(CO)=c(CO2)=c(NO)=1mol/L,c(N2)=0.5mol/L,所以![]() =160,即v正:v逆=160:1;
=160,即v正:v逆=160:1;
(3)A.由图可知,NOx还原成无害物质为氮气,脱硫的产物可能有多种,与温度有关,故A正确;
Bspan>.温度高于1000℃时二氧化硫的含量增大,说明温度越高不利于脱硫,故B错误;
C.根据图3,随CO物质的量分数增大,还原NOx生成氮气曲线斜率变化比较小,而还原SO2需要CO物质的量分数较大时才能将SO2从烟气中分离,说明CO更易与NOx反应,则NOx比SO2更易被CO还原,故C正确;
D.根据图4,COS分压曲线随温度升高减小,S2、CO分压增大,继续升高温度,S2、CO2分压减小,CO分压增大,说明体系中可能发生反应:2COSS2+2CO;4CO2+S24CO+2SO2,故D正确;
故答案为:B;
(4)活化后的V2O5作催化剂,NH3将NO还原成N2,还生成水,反应为4NH3+4NO+O2![]() 4N2+6H2O;
4N2+6H2O;
(5)阴极上亚硫酸根离子得到电子,阴极的电极反应式为2SO32-+4H++2e-=S2O42-+2H2O。


科目:高中化学 来源: 题型:
【题目】人体血液中存在的平衡:H2CO3 ![]() HCO3-,使血液pH保持在7.35 ~ 7.45之间,否则就会发生酸中毒或碱中毒。已知pH随
HCO3-,使血液pH保持在7.35 ~ 7.45之间,否则就会发生酸中毒或碱中毒。已知pH随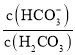 变化关系如表所示,则下列说法中错误的是
变化关系如表所示,则下列说法中错误的是
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
A.pH=7的血液中,c(HCO3-)>c(H2CO3)
B.正常体温下人体发生碱中毒时,c(H+)c(OH-)变大
C.人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒
D.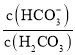 =20.0时,H2CO3的电离程度小于HCO3-的水解程度
=20.0时,H2CO3的电离程度小于HCO3-的水解程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用少量的溴和足量的乙醇制备1,2一二溴乙烷的装置如图所示:

有关数据列表如下:
乙醇 | 1.2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g/cm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | ﹣130 | 9 | ﹣116 |
请按要求回答下列问题:
(1)写出A装置中的化学反应方程式_____;
(2)装置C中盛有氢氧化钠溶液,其作用是_____
(3)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_____
(4)判断该制备反应已经结束的最简单方法是_____;
(5)若产物中有少量未反应的Br2,最好用_____洗涤除去;(填正确选项前的字母)
a 水 b 亚硫酸氢钠 c 碘化钠溶液 d 乙醇
(6)反应过程中应用冷水冷却装置D,其主要目的是_____;但又不能过度冷却(如用冰水),其原因是_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员设想利用如图所示的装置生产硫酸,下列有关说法正确的是( )
A.a 为正极,b 为负极
B.生产过程中氢离子由右移向左
C.从左下口流出的硫酸的质量分数一定大于 50%
D.负极反应式为 SO2+2H2O-2e-=SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
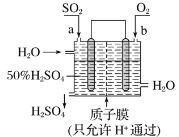
【题目】实验室制备无水二氯化锡的主要步骤如下:
步骤1:在圆底烧瓶中加入1.20 g碎锡箔和5 mL浓盐酸、1滴硝酸,实验装置如图所示。组装好后在95 ℃ 时回流0.5 h,待圆底烧瓶中只剩余少量锡箔为止;
步骤2:将上述反应的上清液迅速转移到仪器X中,在二氧化碳气氛保护下,蒸发浓缩,冷却结晶,过滤得到二氯化锡晶体;
步骤3:在二氯化锡晶体中加入10 mL醋酸酐,即可得无水二氯化锡,过滤;
步骤4:用少量乙醚冲洗三次,置于通风橱内,待乙醚全部挥发后得到无水二氯化锡。
回答下列问题:
(1)步骤1中,圆底烧瓶中发生反应的化学方程式为___________________________________;
冷却水从接口________(填“a”或“b”)进入。实验采取的加热方式是______________;球形冷凝管上连接装有碱石灰的干燥管的目的是____________________________________。
(2)步骤2中,仪器X的名称为__________;二氧化碳气氛的作用是__________________。
(3)步骤3中,醋酸酐的作用是____________________;二氯化锡晶体在进行步骤3操作前应采取的加工措施是________,该加工措施需要仪器的名称是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在有机化学中广泛采用系统命名法,根据系统命名法原则,回答下列问题:
①系统命名法命名下列物质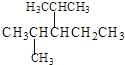 ___;
___;
②3,4-二甲基-2-戊烯的结构简式是___;
(2)![]() 中含有的官能团的名称为__。
中含有的官能团的名称为__。
(3)按要求书写下列化学方程式:
①甲苯制备TNT___;
②实验室制备乙烯___。
(4)下列物质的沸点按由高到低的顺序排列正确的是__。
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3
A.④③②① B.②④③① C.②④①③ D.④②①③
(5)现有下列6种与人们生产生活相关的有机物:①CH3COOH(调味剂)②HCOOCH3(烟草熏蒸剂)③![]() (制酚醛树脂)④
(制酚醛树脂)④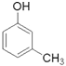 (生产杀虫剂)⑤CH2=CH-CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)。其中与①互为同分异构体的是___(填序号)。
(生产杀虫剂)⑤CH2=CH-CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)。其中与①互为同分异构体的是___(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数值,下列叙述中正确的
A.0.4 mol NH3与0.6 mol O2在催化剂的作用下充分反应,得到NO的分子数为0.4NA
B.C60和石墨的混合物共1.8 g,含碳原子数目为0.15NA
C.1 L 0.1 mol/LNH4Al(SO4)2溶液中阳离子总数小于0.2NA
D.5.6 g铁在足量的O2中燃烧,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. HF、HCl、HBr、HI的熔沸点依次升高
B. CH4、CCl4都是含有极性键的非极性分子
C. CS2、H2S、C2H2都是直线形分子
D. 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无论在办公室还是居室里,在漂亮的花瓶中插上一束美丽的鲜花,将会给紧张而又忙碌的工作、生活带来轻松和愉悦的心情。如果在花瓶中加入“鲜花保鲜剂”,就会延长鲜花的寿命。下表是1L“鲜花保鲜剂”的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g·mol-1) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
(1)“鲜花保鲜剂”中物质的量浓度最大的成分是________(填写名称)。
(2)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林中不含K+)_________(只要求写表达式,不需计算)mol·L-1。
(3)配制过程中,下列操作配制结果没有影响的是________(填字母)。
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视液面
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaC1溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)欲确定“鲜花保鲜剂”中硝酸银的浓度,可加入的试剂中含有______。(填化学符号)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com