
ij��ɫ����Һ���ܺ����������ӣ�K����Al3����Fe3����Ba2����NO3����SO42����HCO3����
Cl���ȣ�ȡ����Һ��������ʵ�飺
�ٽ���Һ������ɫʯ����ֽ�ϣ���ֽ�Ժ�ɫ��
��ȡ��Һ����������ͭƬ��ϡ���Ṳ�ȣ�������ɫ���壬��������������������Ϊ����ɫ��
��ȡ��Һ���������백ˮ�а�ɫ�������ɣ��������������ˮ����������ʧ��
��ȡ��Һ�����������Ȼ�����Һ������ɫ������
��ȡʵ��ܺ�ij�����Һ��������������Һ������ɫ�������ټ��������ϡ���ᣬ��������ʧ��
��ش��������⣺
����ʵ����У���ͼ��ʾ�IJ�������ȷ����___________������ţ���
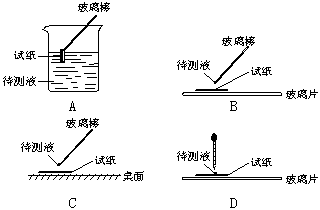
�Ƹ�������ʵ���ж�ԭ��Һ�п϶����ڵ������ǣ� ���϶������ڵ������ǣ� ��
��д����ڢۢ�����ʵ���йص����ӷ���ʽ��
�ڣ� ��
�ۣ� ��
�ܣ� ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һλͬѧ������6 mol��L��1��H2SO4��Һ�������������ֲ�ͬŨ�ȵ������240 mL 1 m ol��L��1�������150 mL 25%������(�ѣ�1.18 g��mL��1)����������18 mol��L��1��Ũ���ᡣ���⣬�����������ֹ�������ƿ��250 mL����ƿ��500 mL����ƿ��1 000 mL����ƿ����λͬѧϣ�����٢���������ȫ�����꣬���㲿�����ɢ۲��䡣��ͨ�����㣬������λͬѧȷ��ѡ�����ֹ�������ƿ���Լ���ҪŨ���������Ƕ��١�
ol��L��1�������150 mL 25%������(�ѣ�1.18 g��mL��1)����������18 mol��L��1��Ũ���ᡣ���⣬�����������ֹ�������ƿ��250 mL����ƿ��500 mL����ƿ��1 000 mL����ƿ����λͬѧϣ�����٢���������ȫ�����꣬���㲿�����ɢ۲��䡣��ͨ�����㣬������λͬѧȷ��ѡ�����ֹ�������ƿ���Լ���ҪŨ���������Ƕ��١�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������������Һ������������ԭ��Ӧ�����ܴ����������
A. H3O����NO3����Fe2����Na�� B. Ag����NO3����Cl����K��
C. K����Ba2����OH����SO42�� D. Cu2����NH4����Br����OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Na2S��Һ�����й�ϵ����ȷ����
A��c(Na+) =2c(HS��) +2c(S2��) +c(H2S) B��c(Na+) +c(H+)=c(OH��)+c(HS��)+2c(S2��)
C��c(Na+)��c(S2��)��c(OH��)��c(HS��) D��c(OH��)=c(HS��)+c(H+)+c(H2S)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪ij��ɫ������Һ�����������ӽ���Na+��CH3COO-��H+��OH-�������ӣ��Իش��������⣺
�Ÿ���Һ�������������ӵ����ʵ���Ũ�ȴ�С֮��Ĺ�ϵ�Ƿ�ֻ��һ�ֿ��ܣ���ǡ�������ԭ���ǣ� ��
��ijѧ��������Һ�е��������ӵ����ʵ���Ũ�Ȱ��Ӵ�С��˳�������������ֿ��ܣ����к������ǣ�
A. c(Na+)>c(CH3COO��)>c(OH��)>c(H+) B. c(CH3COO��)=c(Na+)>c(OH��)=c(H+)
C. c(H+)>c(OH��)>c(Na+)>c(CH3COO��) D. c(Na+)>c(CH3COO��)>c(H+)>c(OH��)
62. ��������ȡ0.2mol��L��1HCl��Һ��0.2mol��L��1 MOH��Һ��������(���Ի�Ϻ���Һ����ı仯)����û����Һ��pH=6���Իش��������⣺
�� �����Һ��ˮ�������c(H+)_ _0.2mol��L��1 HCl��Һ��ˮ�������c(H+)��(�>������<������=��)
�� ��������Һ��������ʽ�ľ�ȷ������(���������)��
c(Cl��) ��c(M+) = mol��L��1��
c(H+) ��c(MOH) = ____ mol��L��1
�����������ȡ0.2mol��L��1 MOH��Һ��0.1 mol��L��1 HCl��Һ�������ϣ���û����Һ��pH<7����˵��MOH�ĵ���̶�______MCl��ˮ��̶ȡ�(�>������<������=��)����Һ�и�����Ũ���ɴ�С��˳��Ϊ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����ȷ����(����)
A�����ۡ���ά�صȸ߷��ӻ���������ڴ�����
B�����������ﶼ�Ǽ���������
C��ʳ�ס����ʳ�ηֱ������ᡢ���
D�������ЧӦ������������Һ�뽺��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����йػ�ѧ�����ʾ��ȷ����(����)
A����ͼ�еĢ���N2�ĵ���ʽ
B����ͼ�еĢ���S2���Ľṹʾ��ͼ
C��������Ϊ53��������Ϊ78�ĵ�ԭ�ӣ�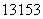 I
I
D����ͼ ��ΪCO2�Ľṹʽ
N⋮⋮N��  �� O��C��O
�� O��C��O
���١����� �ڡ������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����״���µ�ij����(Ħ������ΪM g/mol)����a gˮ�У�������Һ���ܶ�Ϊb g/cm3�����ʵ���Ũ��Ϊc mol/L��������ˮ�еĸ����������(����)
A.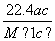 L B.
L B.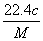 L
L
C.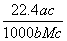 L D.
L D.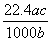 L
L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͼ������4��̼ԭ�ӽ�ϳɵ�6���л���(��ԭ��û�л���)��
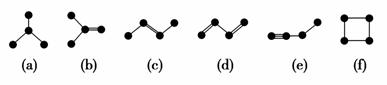
(1)�л���(a)��һ��ͬ���칹�壬��д����ṹ��ʽ________��
(2)�����л�������(c)��Ϊͬ���칹�����________(�����)��
(3)��дһ����(e)��Ϊͬϵ����л���Ľṹ��ʽ________��
(4)(a)(b)(c)(d)(e)���������У�4��̼ԭ��һ������ͬһƽ�����________(�����)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com