
����Ŀ��I.ijһ��ˮ��Һ�н��еķ�Ӧ��ϵ�У��з�Ӧ��������ﹲ�������ʣ�������������: HCl(Ũ)��KMnO4��MnCl2��H2O��Cl2�� KCl����֪Cl2��KCl Ϊ�����
��1���÷�Ӧ�е���������_______(д��ѧʽ)����������Ϊ____ (д��ѧʽ)���÷�Ӧ�У����������뻹ԭ��������ʵ���֮��Ϊ__________
��2�� д���÷�Ӧ�����ӷ���ʽ:________________
��3�� �õ����ű�ʾ�÷�Ӧ����ת�Ƶķ������Ŀ��______________
��4��HCl ��������Ӧ�����ֳ���������___________
��5���ø÷�Ӧ�Ƶ��˱����560mLCl2��������������Ϊ_____mol��ת�Ƶ�����Ϊ______NA(NA��ʾ����٤��������ֵ)��
��.������ر���Һ���������ζ��������ʵĺ������ø�����ط��ŽӲⶨʯ��ʯ��CaCO3�ĺ����ķ���Ϊ: ��ȡ����0.1250g����ϡ�����ܽ�����(NH4)2C2O4��CaC2O4����������������ϴ�Ӻ�����ϡ�����С��ζ����ɵ�H2C2O4 ��ȥŨ��Ϊ0.0 16mo/LKMnO4 ��Һ25.00mL��
��1��д��CaC2O4�����ܽ�����ӷ���ʽ:___________________
��2����ƽ��������и�����صζ����ᷴӦ�����ӷ���ʽ:_____________
��MnO4-+ ��H2C2O4+H+=��Mn2++��CO2��+��
��3����ʯ��ʯ��CaCO3�İٷֺ���:_______
���ζ���Ӧ�в����ı�״���µ�CO2����Ϊ_____mL (������λС��)��
���𰸡� KMnO4 Cl2 5:2 2MnO4-+ 16H++10Cl-=2Mn2++5Cl2��+8H2O  ��ԭ�ԡ����� 0.05 0.05 CaC2O4+2H+ ==Ca2++H2C2O4 2��5��6��2��10��8H2O 80% 44.80
��ԭ�ԡ����� 0.05 0.05 CaC2O4+2H+ ==Ca2++H2C2O4 2��5��6��2��10��8H2O 80% 44.80
��������I.��1������������HCl(Ũ)��KMnO4��MnCl2��H2O��Cl2��KCl��ɵ�������ԭ��Ӧ����֪Cl2��KClΪ��������Ƿ�Ӧ��HCl(Ũ)������ԭ����������Ԫ�ش�-1������Ϊ0�ۣ���KMnO4�������������ϼ۴�+7����+2����MnCl2��H2O������ٸ���������ԭ��Ӧ��ƽԭ�����տɵ÷�Ӧ��2KMnO4+ 16HCl(Ũ)= 2MnCl2+2KCl+ 5Cl2��+ 8H2O������1���÷�Ӧ�е���������KMnO4����������ΪCl2�����ݷ���ʽ��֪����������Cl2�뻹ԭ����MnCl2�����ʵ���֮��Ϊ5��2����2���÷�Ӧ�����ӷ���ʽΪ��2MnO4-+16H++10Cl-=2Mn2++5Cl2��+8H2O����3���õ����ű�ʾ�÷�Ӧ����ת�Ƶķ������ĿΪ�� ����4��HCl��������Ӧ�����ֳ����������ǻ�ԭ�Ժ����ԣ���5���ø÷�Ӧ�Ƶ��˱����560mLCl2�����ʵ���Ϊ
����4��HCl��������Ӧ�����ֳ����������ǻ�ԭ�Ժ����ԣ���5���ø÷�Ӧ�Ƶ��˱����560mLCl2�����ʵ���Ϊ![]() =0.025mol����������������Ϊ0.025mol��2=0.05mol��ת�Ƶ�����Ϊ0.05NA��
=0.025mol����������������Ϊ0.025mol��2=0.05mol��ת�Ƶ�����Ϊ0.05NA��
��.��1��CaC2O4�����ܽ�����������ӷ���ʽΪ��CaC2O4+2H+=Ca2++H2C2O4����2��H2C2O4��Ӧ��C��+3������Ϊ������̼��+4�ۣ�MnO4-��Mn��+7�۽�ΪMn2+�е�+2�ۣ�Ҫʹ�������뻹ԭ����ʧ���������H2C2O4ϵ��Ϊ5��MnO4-ϵ��Ϊ2�����ԭ�Ӹ����غ㣬��Ӧ����ʽ��5H2C2O4+2 MnO4-+6H+=2Mn2++10CO2��+8H2O����3�������������غ㼰��Ӧ����ʽ�����ʵ�����ϵ�ɵù�ϵ���£������������Ϊx����
5CaCO3~5 CaC2O4~ 5H2C2O4~2MnO4-
5��100g 2mol
0.1250xg 0.016mol/L��0.025L
![]() =
=![]() �����x=80%�������ݷ�Ӧ5H2C2O4+2 MnO4-+6H+=2Mn2++10CO2��+8H2O��֪���ζ���Ӧ�в���CO2�����ʵ���Ϊ��n(CO2)=5n(MnO4-)=5��0.016mol/L��0.025L=0.002mol����״���µ�CO2����Ϊ0.002mol��22.4L/mol=0.0448L=44.80mL��
�����x=80%�������ݷ�Ӧ5H2C2O4+2 MnO4-+6H+=2Mn2++10CO2��+8H2O��֪���ζ���Ӧ�в���CO2�����ʵ���Ϊ��n(CO2)=5n(MnO4-)=5��0.016mol/L��0.025L=0.002mol����״���µ�CO2����Ϊ0.002mol��22.4L/mol=0.0448L=44.80mL��


 �㽭�¿γ���άĿ�������ʱ��ѵϵ�д�
�㽭�¿γ���άĿ�������ʱ��ѵϵ�д� ��������ϵ�д�
��������ϵ�д� ���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������¶ȼƴ����ڵ����ϣ����ڹ����ϸ���һ�������Ա��ⷢ�����ж�����������
A. ��Ƿ� B. ɳ��
C. ʯ�� D. ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������������ҪӰ�졣
��1�������Ʊ������á�
�� ��ҵ�ϳɰ��Ļ�ѧ����ʽ�� ��
�� ������������һ��������Ӧ�Ļ�ѧ����ʽ�� ��
��2�����Ķ�����⡣
ˮ���а�����笠�����(ͳ�ư���)�����ļ�ⱸ�ܹ�ע�����ð������������ˮ���а���������ʾ��ͼ���£�
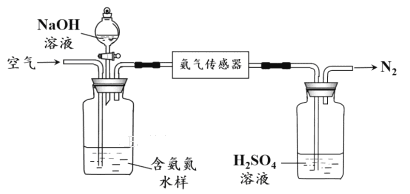
�� ����ƽ��ԭ������������ˮ���м���NaOH��Һ�����ã� ��
�� �����ð�����������1 Lˮ���еİ�����ȫת��ΪN2ʱ��ת�Ƶ��ӵ����ʵ���Ϊ6��10-4 mol ����ˮ���а���(������)����Ϊ mg��L-1��
��3������ת����ȥ����
����ȼ�ϵ��(MFC)��һ���ִ�������ȥ����������ͼΪMFC̼������ͬʱȥ���ĵ�ת��ϵͳԭ��ʾ��ͼ��

�� ��֪A��B��������CO2��N2��д��A���ĵ缫��Ӧʽ�� ��
�� �û�ѧ�������NH4+ȥ����ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����I��ʵ���ҿ������̿�(��Ҫ�ɷ�ΪMnO2)�Ʊ�KMnO4���������£����̿�����Ĺ���KOH��KClO3�ڸ����·�Ӧ�����������(K2MnO4)��KCl����ˮ�ܽ⣬��ȥ��������Һ�ữ��K2MnO4ת��ΪMnO2��KMnO4����ȥMnO2������Ũ����Һ���ᾧ�õ�����ɫ����״KMnO4���Իش�
(1)���̿��Ʊ�K2MnO4�Ļ�ѧ����ʽ��____________________________��
(2)K2MnO4�Ʊ�KMnO4�����ӷ���ʽ��__________________________________��
(3)KMnO4�����ȵ�ϡ�����ữ��Na2C2O4��Ӧ������Mn2����CO2���÷�Ӧ�Ļ�ѧ����ʽ��________________________________________________��
��II������Na2SO3��Ʒ���ֱ�������ʵ�����������_____________________��
��III����ǿ����Һ��NaClO��Fe(OH)3��Ӧ����Na2FeO4��_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п����������ǽ���������ص�һ�֣��������ҺΪKOH��Һʱ����ӦΪ��2Zn+O2+4OH-+2H2O=2Zn(OH)42-�������й�˵����ȷ����
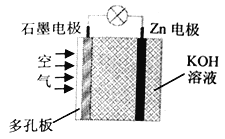
A. ʯī�缫�Ϸ���������Ӧ B. ����������Һ��pH���ϼ�С
C. OH-��п�缫����ʯī�缫 D. Zn �缫�Ϸ�����Ӧ��Zn-2e-+4OH-=Zn(OH)42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ����ʽ2C+SiO2 ![]() 2CO+Si�����ǽ����ԣ�̼>��
2CO+Si�����ǽ����ԣ�̼>��
B. һ������������������������ܱ������г�ַ�Ӧ����FeCl2����
C. ��������Ũ�������ʢ�й�����ͭ�۵��Թ��У��������ֻ��NO2
D. �����Ʊ��ı�����ˮ�м���̼��Ʒ�ĩ������ǿ��ˮ��Ư����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ǿ������Һ��,�ܴ����������������
A. Na+��K+��OH-��Cl- B. K+��Fe2+��Cl-��NO3-
C. Na+��ClO-��.SO42-��I- D. Mg2+��Na+��SO42-��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йؽ����Ĺ�ҵ�Ʒ��У���ȷ����:
A. �Ժ�ˮΪԭ���Ƶþ��Σ��ٵ�⾫�ε�ˮ��Һ��ȡ��
B. �ú�ˮ��ʯ�����Ϊԭ�ϣ���һϵ�й����Ƶ�����þ����H2��ԭ����þ�Ƶ�þ
C. ������ʯ����̿��������ʯ��ʯ��Ϊԭ�ϣ�ͨ����Ӧ������CO�ڸ����»�ԭ����ʯ�Ƶ���
D. ���������л�����������Ƶ��Ȼ������壬������ڵ��Ȼ����õ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ļ��������Ź㷺����;����ش��������⣺
��1������Ԫ�����ڱ��е�λ��Ϊ_________�������Ų�ʽ��________����Ԫ����������Ȼͬλ��10B��11B����Ԫ�صĽ������ԭ������Ϊ10.8��������ͬλ��ԭ�ӵ�ԭ�Ӹ���֮��Ϊ_______��
��2��������B����һ����������NaOH��Һ��Ӧ����NaBO2��һ�����壬��д���÷�Ӧ�Ļ�ѧ����ʽ________________��
��3�����ᣨH3BO3����һ�ְ�ɫƬ״���壬����ˮ���������������֯���źͻ��ķ����������á�������һԪ���ᣬ����ʱ0.1mol/L�����pHΪ5����������ĵ��볣��K��__________�������ᣨHBF4����һ��ǿ�ᣬ��������״̬������ˮ�У���д��BF4���ĵ���ʽ__________��
��4��B2H6�����һ����̬�⻯�����������飨C2H6�����ƶ�����Ϊ�����顣
�پ��ⶨB2H6��Bԭ�������Ҳ����8���ӽṹ���ɴ��Ʋ�B2H6��C2H6���ӽṹ_________�����ͬ������ͬ������
��B2H6����BF3��NaBH4��һ�������·�Ӧ�Ƶã�д���÷�Ӧ�Ļ�ѧ����ʽ_________��
��B2H6��ǿ��ԭ��������ˮ��Ӧ����H3BO3��H2������0.1mol B2H6��ˮ��ȫ��Ӧ�������H2�ڱ�״���µ����Ϊ_________L��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com