
【题目】用滴有酚酞和氯化钠溶液的湿润滤纸分别做甲、乙两个实验,下列判断正确的是

A. b、d两极附近均有气泡冒出
B. 甲乙中变红色的电极均发生了还原反应
C. a、d两极电极反应均为:Fe-2e-=Fe2+
D. 乙中铁棒比甲中铁棒更易腐蚀
【答案】B
【解析】甲为原电池,为钢铁的吸氧腐蚀,a(Fe)为负极,a电极的电极反应式为:Fe-2e-=Fe2+;b(C)为正极,b电极的电极反应式为:O2+4e-+2H2O=4OH-。乙为电解池,c(C)为阳极,c电极的电极反应式为:2Cl--2e-=Cl2↑;d(Fe)为阴极,d电极的电极反应式为:2H++2e-=H2↑。A项,b极附近没有气泡冒出,错误;B项,甲中变红色的是正极,乙中变红色的是阴极,原电池中的正极和电解池中的阴极都发生得电子的还原反应,正确;C项,d电极的电极反应为:2H++2e-=H2↑,错误;D项,甲中铁棒为原电池的负极被腐蚀,乙中铁棒为电解池的阴极被保护,甲中铁棒比乙中铁棒更易腐蚀,错误;答案选B。


科目:高中化学 来源: 题型:
【题目】下列关于某些离子的检验及结论,一定正确的是
A. 加入稀盐酸产生无色气体,将该气体通入澄清石块水中变浑浊,则一定有CO32-
B. 加入氯化钡帘液有白色沉淀产生,再加稀硝酸,沉淀不消失,则一定有SO42-
C. 加入KSCN溶液无明显现象,再加入新制的氯水,溶液变血红,则一定有Fe2+
D. 加入Na2CO3溶液产生白色沉淀,再加盐酸,白色沉淀消失,则一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列叙述正确的是
A. 0.5mol熔融的NaHSO4中含有的离子数目为NA
B. 12g金刚石中含有C-C键数目为4NA
C. 25℃时,Ksp(BaSO4)=1×10-10,则饱和BaSO4溶液中Ba2+数目为1×10-5NA
D. 1mol的Na2O和BaO2混合物中含有的阴、阳离子总数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,则下列叙述中正确的是
A. 原子序数:D>C>B>A B. 原子半径:B>A>C>D
C. 离子半径:C3->D->A2+>B+ D. 氧化性:A2+>B+,还原性:C3-<D-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里化学试剂的保存方法是不相同的,下图中A、B、C、D是常见的一些保存药品的试剂瓶。请把下列常见试剂的序号填写在各试剂瓶下面的括号内:①浓硫酸②碳酸钠溶液 ③铜片 ④酒精 ⑤氯水 ⑥浓硝酸
A | B | C | D |
|
|
|
|
__________ | __________ | __________ | __________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.氧化还原反应的实质是电子的转移
B.置换反应不一定是氧化还原反应
C.氧化剂发生氧化反应
D.有单质参加或者生成的反应一定属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是( ) 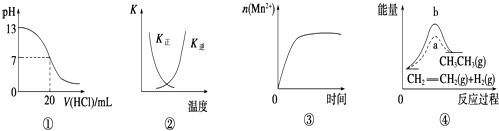
A.图①表示25℃时,用0.1 mol/L盐酸滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g)+O2(g)2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol/L KMnO4酸性溶液与过量的0.1 mol/L H2C2O4溶液混合时,n(Mn2+)随时间的变化
D.图④中a、b曲线分别表示反应:CH2═CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的总能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式表达正确的是(![]() 的绝对值均正确)
的绝对值均正确)
A. C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) △H=–1367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H= +57.3kJ/mol(中和热)
C. S(s)+O2(g)=SO2(g) △H=–269.8kJ/mol (反应热)
D. 2NO2=O2+2NO △H= +116.2kJ/mol (反应热)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com