
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:选择题
 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 易溶于水,也易溶于有机溶剂 | |
| B. | 1 mol该烃含有4 mol碳碳双键 | |
| C. | 能发生聚合反应,其产物可表示为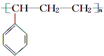 | |
| D. | 既能使溴水褪色,又能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:C>N | B. | 酸性:HClO4>H2CO3 | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 热稳定性H2O>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
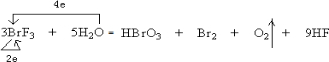 ,还原剂是H2O和BrF3,氧化剂是BrF3.氧化产物是HBrO3、O2. 还原产物是Br2(以上均填化学式)
,还原剂是H2O和BrF3,氧化剂是BrF3.氧化产物是HBrO3、O2. 还原产物是Br2(以上均填化学式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(NH4+)+c(OH-)>c(Cl-)+c(H+) | |
| B. | 等体积、等物质的量浓度为Na2CO3溶液与NaHCO3溶液混合后:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| C. | 浓度相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液中,c(NH4+)大小顺序为:②>③>① | |
| D. | 0.1 mol/L Na2CO3溶液与0.1 mol/L HCl溶液等体积混合,所得溶液中:c(H+)+c(H2CO3)=c(CO32-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤⑦ | B. | ①②③④⑥ | C. | ①④⑦⑥ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应的△H<0 | |
| B. | 其他条件不变,升高温度反应的平衡常数增大 | |
| C. | 300℃时,0~t1min内CH3OH的平均生成速率为$\frac{{n}_{1}}{{t}_{1}}$1mol•L-1•min-1 | |
| D. | A点的反应体系温度从300℃升高到500℃,达到平衡时,$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com