
【题目】如图为原电池装置示意图。
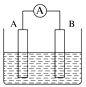
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是________(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式:______________________________。
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。写出B电极反应式:__________________________;该电池在工作时,A电极的质量将________(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1 mol H2SO4,则转移电子的数目为________。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出A电极反应式:___________________________________;该电池在工作一段时间后,溶液的碱性将________(填“增强”“减弱”或“不变”)。
(4)若A、B均为铂片,电解质为H2SO4溶液,分别从A、B两极通入CH4和O2,该电池即为甲烷燃料电池,写出A电极反应式:___________________________________;若该电池反应消耗了6.4克CH4,则转移电子的数目为________。
【答案】B Al-3e-+4OH- =AlO2-+2H2O PbO2+SO42-+4H++2e-=PbSO4+2H2O 增加 0.1NA H2+2OH--2e-=2H2O 减弱 CH4-8e-+2H2O=CO2+8H+ 3.2NA
【解析】
(1)利用构成原电池的条件之一:负极与电解质溶液发生氧化还原反应进行分析;
(2)根据总反应式以及原电池工作原理,PbO2在正极上发生反应,得到电子,生成PbSO4,据此分析;
(3)燃料电池中通燃料一极为负极,通氧气或空气一极为正极,然后书写电极反应式;
(4) 燃料电池中通燃料一极为负极,通氧气或空气一极为正极,然后书写电极反应式;
(1)常温下,铝与浓硝酸发生钝化反应,Cu能与硝酸发生氧化还原反应,因此Cu作负极; Al能与NaOH溶液发生氧化还原反应,Cu不与氢氧化钠溶液反应,因此Al为负极;故选项B正确;Al与氢氧化钠溶液的反应离子方程式为 Al-3e-+4OH-=AlO2-+2H2O;
(2)B电极为PbO2,根据总反应,PbO2中Pb的化合价降低,根据原电池工作原理,B电极为正极,电极反应式为PbO2+2e-+SO42-+4H+=PbSO4+2H2O;A电极为负极,电极反应式为Pb-2e-+SO42-=PbSO4,PbSO4微溶于水,因此A电极的质量增加;根据总反应,消耗0.1mol硫酸的同时,消耗PbO2的物质的量为![]() =0.05mol,即转移电子物质的量为0.05mol×2=0.1mol,转移电子的数目是0.1NA;
=0.05mol,即转移电子物质的量为0.05mol×2=0.1mol,转移电子的数目是0.1NA;
(3)A电极通入H2,即该电极为负极,电解质为KOH溶液,因此A电极反应式为H2+2OH--2e-=2H2O;构成氢氧燃料电池,总反应方程式为2H2+O2=2H2O,生成的H2O稀释KOH,溶液的碱性减弱;
(4)A电极通入CH4,该电极为负极,电解质为H2SO4溶液,其电极反应式为CH4+2H2O-8e-=CO2+8H+;根据A电极反应式,消耗6.4gCH4,转移电子的数目为![]() =3.2NA。
=3.2NA。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氰(CN)2,硫氰(SCN)2等称为拟卤素,与卤素单质性质相似,它们的阴离子与也卤素阴离子性质相似,阴离子的还原性顺序为: Cl-<Br-<CN-<SCN-<I-,又知,拟卤素形成的无氧酸和含氧酸一般为弱酸,下列反应中,不合理的是
A.4HCN(浓)+MnO2![]() Mn(CN)2+(CN)2↑+2H2O
Mn(CN)2+(CN)2↑+2H2O
B.(CN)2+H2O=2H++CN-+CNO-
C.(CN)2+2OH-=CN-+CNO-+H2O
D.(CN)2+2SCN-=2CN-+(SCN)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CCuS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化, 产生经济效益。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应I:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.8kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.8kJ·mol-1
反应II:CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) △H2=+23.4kJ·mol-1
2CH3OH(g) △H2=+23.4kJ·mol-1
反应III:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=_____________kJ·mol-1
(2)恒温恒容条件下,在密闭容器中通人等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是_______(填序号)。
A.容器内的混合气体的密度保持不变B.反应体系总压强保持不变
C.CH3OH和CO2的浓度之比保持不变D.断裂3NA个H-O键同时断裂2NA个C=O键
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加人等物质的量的 CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 1.6 | 1.6 | 0.8 |
此时![]() ___
___![]() (填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH 体积分数 V(CH3OH)%= _____%。
(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH 体积分数 V(CH3OH)%= _____%。
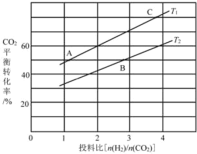
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入3 L的密闭容器中,10 min后反应达到平衡状态,则0-10 min内的平均反应速率V(CH3OCH3)=____。
(5)恒压下将CO2和氏按体积比1 :3混合,在 不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。
其中:CH3OH的选择性=![]() ×100%
×100%
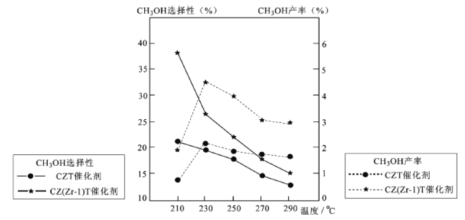
②在上述条件下合成甲醇的工业条件是_________。
A. 230℃ B. 210℃ C.催化剂 CZT D.催化剂 CZ(Zr-1)T
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易反应,生成一种氯化物和两种常见的氮氧化物,其中一种呈红棕色。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:为制备纯净干燥的气体,下表中缺少的药品是:
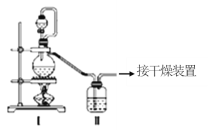
制备原料 | 装置Ⅰ | 装置Ⅱ | |
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①__ | 饱和食盐水 |
制备纯净NO | Cu | 稀硝酸 | ②__ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
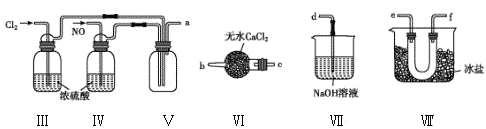
①装置连接顺序为a→____(按气流自左向右方向,用小写字母表示)。
②为了使气体充分反应,实验中先通入Cl2,待装置Ⅴ中充满黄绿色气体时,再将NO缓缓通入,此操作的目的是______(回答一条即可)。
③装置Ⅴ生成NOCl的化学方程式是________。
④装置Ⅵ的作用为___,若无该装置,Ⅷ中NOCl可能发生反应的化学方程式为__。
(3)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:
取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为bmL。亚硝酰氯(NOCl)的质量分数为______(用代数式表示即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g) ![]() CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )
CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )

A. 该反应的ΔH>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 在T2时,若反应体系处于状态D,则此时一定有v正<v逆
D. 在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某仅由碳、氢、氧三种元素组成的有机化合物,经测定其相对分子质量为90。取有机物样品1.8 g,在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重1.08 g和2.64 g。试求该有机物的分子式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如下合成路线,甲经二步转化为丙:
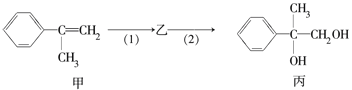
下列叙述错误的是
A. 甲和丙均可与酸性KMnO4溶液发生反应
B. 反应(1)的无机试剂是液溴,铁作催化剂
C. 步骤(2)产物中可能含有未反应的甲,可用溴水检验是否含甲
D. 反应(2)属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用CuCl作O2、CO的吸收剂,某同学利用如图所示装置模拟工业上测定高炉煤气中CO、CO2、N2和O2的含量。
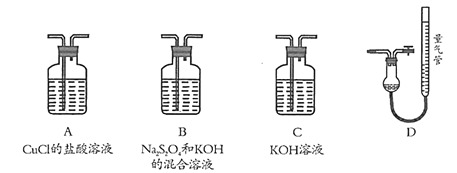
已知:Na2S2O4和KOH的混合溶液也能吸收氧气。
(1)装置的连接顺序应为_______→D
(2)用D装置测N2含量,读数时应注意______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下A、B、C的如下图所示的转化关系,且△H=△H1+△H2。则A、C可能是( )

①Fe、FeCl3 ②C、CO2 ③AlCl3、NaAlO2 ④NaOH、NaHCO3 ⑤S、CuS ⑥Na2CO3、CO2
A.②③④⑥ B.②③④⑤⑥ C.①②③④⑥ D.①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com