
【题目】反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,
C(g)+D(g)过程中的能量变化如图所示,
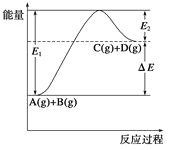
①正反应为放热反应,
②反应物总能量低于生成物总能量
③反应物的总键能小于生成物的总键能,
④1molA与1molB充分反应后,能量变化为ΔE,
⑤加入催化剂后,反应加快,ΔE减小,
⑥反应达到平衡时,升高温度,A的转化率增大,
⑦升高温度可增大正反应速率,降低逆反应速率,
⑧E2是反应C(g)+D(g)![]() A(g)+B(g)的活化能,
A(g)+B(g)的活化能,
以上有关说法正确的是
A.⑤⑥⑦⑧ B.①②③④ C.①③⑤⑦ D.②⑥⑧
【答案】D
【解析】
试题分析:①由于生成物的能量高于反应物的能量,所以该反应的正反应为吸热反应,错误;②从图示可知反应物总能量低于生成物总能量,正确;③反应物的总键能大于生成物的总键能,错误;④反应过程的能量变化既与物质的多少有关,也和物质的状态有关,错误;⑤加入催化剂后,反应加快,但是ΔE不变,错误;⑥由于该反应的正反应是吸热反应,所以反应达到平衡时,升高温度,根据平衡移动原理,化学平衡向吸热反应方向移动,即向正反应方向移动,所以A的转化率增大,正确;⑦升高温度可增大正反应速率和逆反应速率,由于正反应速率增大的多于逆反应速率增大的倍数,所以平衡正向移动,错误;⑧E2是反应C(g)+D(g) ![]() A(g)+B(g)的活化能,正确。故说法正确的是②⑥⑧,答案选D。
A(g)+B(g)的活化能,正确。故说法正确的是②⑥⑧,答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A. 活化分子间的碰撞一定是有效碰撞
B. 其他条件相同时,增大反应物浓度,反应物中活化分子的百分数增加
C. 焓变和熵变都与反应的自发性有关,它们都能独立地作为自发性的判据
D. 常温下,FeCl3溶液中由水电离出的c (H+)一定大于1×10﹣7mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、前20号主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核最外层电子数之和为18。A的原子半径为自然界最小,B、F为同一主族,E为地壳中含量最多的金属元素,F原子的最外层与最内层电子数相等。C、D可以形成两种常见化合物。试回答以下问题:
(1)写出C与F元素形成的化合物的电子式
(2)A、C、D三种元素形成的化合物C2A4D2中一定含有 。(填“离子键”、“极性共价键”或“非极性共价键”)
(3)由D、E、F形成的简单离子的离子半径由大到小的顺序是 。(用元素离子符号表示)
(4)元素B的性质与元素E的性质很相似,试写出以下反应的离子方程式:
B的氧化物与氢氧化钠溶液反应:
Ⅱ、现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙三分子均为10电子粒子,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如下图所示:

(1)根据以上条件可以确定A、B、C、D四种元素中的三种元素。不能被确定的第四种元素是________。(填写A B C D中的一种)
(2)依据下列条件可以进一步确定上述第四种元素:①甲与丙以及乙与丙均能够发生反应 ②甲、丙都是无色、有刺激性气味的物质。据此,写出C+丙―→乙+丁的化学反应方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中字母所代表的物质均为中学化学常见物质。其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料;常温下C、D、H为气体单质。单质E、M、N为金属,N是地壳中含量最大的金属元素。Y是红褐色沉淀。这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。试回答下列问题:
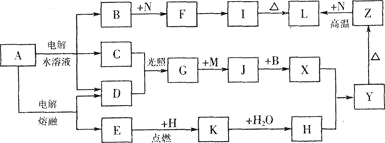
(1)Z→L反应的名称是______________。
(2)K的电子式为______________。
(3)写出B→F的离子方程式______________。
(4)写出K与CO2反应的化学方程式______________。
(5)Y与NaClO和B的混合溶液作用,是制备绿色水处理剂(Na2MO4)的一种方法,请写出该反应的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“酸雨”的形成主要是由于( )
A.森林遭到乱砍滥伐,破坏了生态平衡 B.工业上大量燃烧含硫燃料
C.汽车排出大量的尾气 D.大气中二氧化碳含量增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定物质的量浓度的NaCl、MgCl2、AlCl3三种溶液与同体积同浓度的AgNO3完全反应,消耗三溶液的体积比为3:2:1,则三种溶液中Cl-的物质的量浓度之比为
A.1:1:1 B.1:2:3 C.3:2:1 D.2:3:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-197k/mol。在相同的温度下,向体积相同的三个密闭容器中分别充入气体:(甲)2molSO2和1molO2;(乙)1molSO2和0.5molO2;(丙)2molSO3。反应达平衡时,下列关系一定正确的是
2SO3(g)ΔH=-197k/mol。在相同的温度下,向体积相同的三个密闭容器中分别充入气体:(甲)2molSO2和1molO2;(乙)1molSO2和0.5molO2;(丙)2molSO3。反应达平衡时,下列关系一定正确的是
A.容器内压强P:P甲=P丙> 2P乙
B.SO3的质量m:m甲=m丙> 2m乙
C.c(SO2)与c(O2)之比k:k甲=k丙> k乙
D.反应放出或吸收热量的数值Q:Q甲=Q丙> 2Q乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com