
分析 影响反应速率的因素有:温度、浓度、压强、催化剂、反应物接触面积等,温度和催化剂是通过改变活化分子百分数来改变反应速率,浓度、压强是通过改变单位体积内活化分子个数来改变反应速率,据此分析解答.
解答 解:①夏天温度高于冬天,温度越高,活化分子百分数越大,其反应速率越大,所以食品在夏天容易变质,冬天则不会出现该现象,故答案为:温度;
②熔化的KClO3放出气泡很慢,撒入少量MnO2,会很快产生气体,二氧化锰在该反应中作催化剂,增大单位体积内活化分子百分数,所以反应速率增大,故答案为:催化剂;
③工业上常将固体燃料粉碎以提高燃烧效率,是通过增大反应物接触面积来改变反应速率,故答案为:接触面积;
④同浓度等体积的硫酸与盐酸,和同样大小质量相等的锌粒反应,产生气体有快有慢,硫酸中氢离子浓度大于盐酸,导致硫酸反应速率大于盐酸,故答案为:氢离子浓度.
点评 本题考查化学反应速率影响因素,为高频考点,明确温度、压强、浓度、催化剂、反应物接触面积对化学反应速率影响原理是解本题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:CO32-、Al3+、Cl-、NO3- | |
| B. | 无色溶液中:NH4+、K+、CH3COO-、Cl- | |
| C. | pH=1的溶液中:Fe2+、NH4+、Mg2+、NO3- | |
| D. | 水电离的c(H+)=10-12 mol/L的溶液中:Fe3+、SO42-、K+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
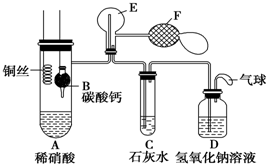 Ⅰ.乙组同学用如图装置来证明铜与稀硝酸反应产生一氧化氮,B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
Ⅰ.乙组同学用如图装置来证明铜与稀硝酸反应产生一氧化氮,B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 500 | 1000 | 1500 |
| C(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1=125,1000s时转化率为50% | |
| C. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1<K2,则T1>T2 | |
| D. | 平衡后其他条件不变,将容器的体积压缩到原来的1/2,则再平衡时C(N2O5)>5.00mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入盐酸以除去硫酸钠中的少量碳酸钠杂质 | |
| B. | 蒸发时,加热到蒸发皿中出现较多量固体时停止加热 | |
| C. | 用分液漏斗分离液体时,先放出下层液体后,再放出上层液体 | |
| D. | 过滤时,用玻璃棒搅拌漏斗内的混合液以加快过滤速度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2HPO4+NaH2PO4 | B. | Na3PO4 | C. | NaH2PO4 | D. | Na3PO4+NaH2PO4 | ||||
| E. | Na3PO4+Na2HPO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com