
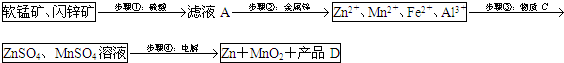
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
分析 (1)MnO2在酸性溶液中分别和CuS和FeS发生氧化还原反应,Mn元素的化合价降低,S元素的化合价升高,且Fe元素化合价升高;
(2)滤液A中含金属离子,加Zn发生置换反应;
(3)由转化可知,铁离子、铝离子转化为沉淀;
(4)步骤④中电解过程中MnO2应在阳极生成,因Mn元素失去电子,阴极上Zn得到电子,得到的硫酸可循环使用.
解答 解:(1)MnO2在酸性溶液中分别和CuS和FeS发生氧化还原反应,Mn元素的化合价降低,S元素的化合价升高,且Fe元素化合价升高,由电子、原子守恒可知,反应分别为MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O,
故答案为:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O;MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O;
(2)由滤液A$\stackrel{步骤②:金属棒}{→}$Zn2+、Mn2+、Fe2+、Al3+,可知加Zn置换出Cu、Cd,故答案为:Cu、Cd;
(3)由转化可知,铁离子、铝离子转化为沉淀,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+;另外一种固体物质可为Zn(OH)2(Mn(OH)2、ZnCO3、MnCO3等)促进铁离子水解转化为沉淀,
故答案为:将Fe2+氧化为Fe3+;Zn(OH)2;
(4)因Mn元素失去电子,可知步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+,硫酸根离子不变,且生成氢离子,可知产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用,
故答案为:阳;Mn2+-2e-+2H2O=MnO2+4H+;H2SO4;用于溶解软锰矿和闪锌矿,循环使用.
点评 本题考查混合物分离提纯的综合应用及物质制备实验,为高频考点,把握简化流程中的反应、混合物分离方法为解答的关键,侧重分析与应用能力的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
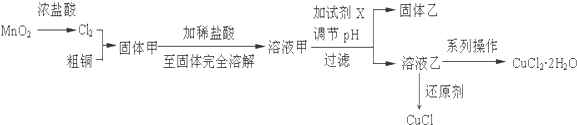
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 给定条件的有机化合物 | 同分异构体数目 |
| A | 分子式为C4H9Cl的有机物 | 3种 |
| B | 分子式为C5H10O2的一元酯 | 8种 |
| C | 分子式为C5H10的环烷烃 | 3种 |
| D | 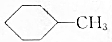 的一溴代物 的一溴代物 | 5种 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
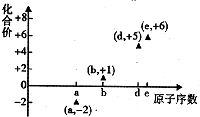 如图是邵分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
如图是邵分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )| A. | 31d和33d属于同种核素 | B. | 第一电离能d>e,电负性d<e | ||
| C. | 气态氢化物的稳定性:a>d>e | D. | a和b形成的化合物不可能含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2FeO4 能与水缓慢反应生成Fe(OH)3 和O2,故可用作水的消毒剂和净化剂 | |
| B. | 钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用 | |
| C. | 太阳能、风能是可再生能源,应大力推广太阳能、风能的使用 | |
| D. | 新型能源生物柴油和矿物油的主要化学成分相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解、蒸发 | B. | 萃取、蒸馏 | C. | 分液、蒸馏 | D. | 萃取、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com