
(9分)X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系:
(1)若该反应是非氧化还原反应
①X为强碱溶液,W是形成酸雨的主要气体,则Y到Z的离子方程式为 。
②X是一种盐,逐滴加入W,溶液中开始无气泡,后产生无色无味气体Z,则Z的电子式为 。
(2)若该反应是氧化还原反应
①X常温下为黄绿色气体,W是生活中应用最广泛的金属之一,则Y的水溶液中加入W生成Z溶液的离子方程式为 。
②X常温下为气体化合物,Z是一种红棕色气体,X气体的检验方法 。X转化为Y的化学方程式为 。
(1)①SO32-+SO2+H2O=HSO3-(2分) ②(2分)
(2)①2Fe3++ Fe = 3Fe2+ (2分)
②湿润的红色石蕊试纸变蓝 (1分) 4NH3+5O2=4NO+6H2O(2分)
解析:(1)形成酸雨的主要气体是SO2,所以Y是亚硫酸盐,亚硫酸盐继续吸收SO2,生成相应的酸式盐,所以离子方程式为SO32-+SO2+H2O=HSO3-。碳酸盐和酸反应开始阶段不产生气体,当碳酸盐完全转化为碳酸氢盐后,再滴入酸才开始出现CO2气体。CO2是由极性键形成的共价化合物,其电子式为。
(2)黄绿色气体是氯气,应用最广泛的金属是铁,则Y是氯化铁,氯化铁氧化单质铁生成氯化亚铁,方程式为2Fe3+ + Fe = 3Fe2+。红棕色气体是NO2,则Y是NO,W是氧气,X是氨气。可以利用氨气是碱性气体进行检验,氨气发生催化氧化即生成NO,方程式为4NH3+5O2=4NO+6H2O。


科目:高中化学 来源: 题型:阅读理解
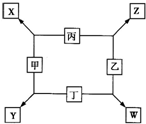 甲、乙、丙、丁均是由短周期元素组成的单质,X、Y、Z、W均为化合物,常温下,X为淡黄色固体,Z遇空气变为红棕色,W能使湿润的红色石蕊试纸变蓝色,工业上常用W来制取Z,其转化关系如右图所示.
甲、乙、丙、丁均是由短周期元素组成的单质,X、Y、Z、W均为化合物,常温下,X为淡黄色固体,Z遇空气变为红棕色,W能使湿润的红色石蕊试纸变蓝色,工业上常用W来制取Z,其转化关系如右图所示.
| ||
| ||
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
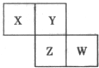 (2012?唐山二模)X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
(2012?唐山二模)X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
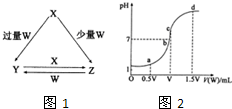 (2013?菏泽二模)X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图1所示(水及部分产物已略去).
(2013?菏泽二模)X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图1所示(水及部分产物已略去). 查看答案和解析>>
科目:高中化学 来源: 题型:
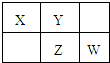 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法正确的是( )| A、原子半径:W>Z>Y>X | B、最高价氧化物对应水化物酸性:Z>W>X | C、4种元素的氢化物中,Z氢化物最稳定 | D、W单质与水反应,生成一种有漂白性物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是元素周期表的一部分,X、Y、Z、W均为短周期元素,X、Z的质子数之和为21.下列说法正确的是( )
如图是元素周期表的一部分,X、Y、Z、W均为短周期元素,X、Z的质子数之和为21.下列说法正确的是( )| A、X元素最多可形成六种氧化物 | B、Y元素的最高价氧化物的水化物是含氧酸中酸性最强的 | C、X元素的非金属性比Y元素非金属性强 | D、Z和X能以共价键结合形成一种无机非金属材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com