
| 催化剂 |
| 加热 |
| 催化剂 |
| 加热 |
| 催化剂 |
| 加热 |
| 0.6 |
| 24 |
| ① |
| 2 |
| ② |
| 2 |
| -196.6 |
| 2 |
| -113.0 |
| 2 |
| 9 |
| 10 |
| c(NO)c(SO3) |
| c(NO2)c(SO2) |
| x2 |
| (a-x)(2a-x) |


 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
 短周期元素Q、W、X、Y、Z在元素周期表中的相对位置如图所示,其中只有Z为金属元素.则下列说法中,正确的是( )
短周期元素Q、W、X、Y、Z在元素周期表中的相对位置如图所示,其中只有Z为金属元素.则下列说法中,正确的是( )| A、W、X两种元素在自然界中都存在相应的单质 |
| B、Q、Y分别与活泼金属元素形成的化合物中仅含离子键 |
| C、Y、Z分别形成的简单离子中,前者的半径较大 |
| D、X、Z的最高价氧化物对应的水化物之间容易相互发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COOH在常温下Ka数值约为l×101-2a |
| B、约有1.0×l0a-14 mol?L-1的水发生电离 |
| C、加热后溶液pH<a |
| D、加少量水后,溶液pH>a |
查看答案和解析>>
科目:高中化学 来源: 题型:
 以镁橄榄石2MgO?SiO2(简写为M2Si)为主晶相制作的镁橄榄石砖,是一种弱碱性耐火材料.可用于有色金属熔炼炉、炼钢平炉蓄热室和水泥回转窑等的内衬.
以镁橄榄石2MgO?SiO2(简写为M2Si)为主晶相制作的镁橄榄石砖,是一种弱碱性耐火材料.可用于有色金属熔炼炉、炼钢平炉蓄热室和水泥回转窑等的内衬.查看答案和解析>>
科目:高中化学 来源: 题型:
A、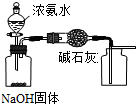 用装置制取干燥纯净的NH3 |
B、 用装置制备Fe(OH)2并能较长时间观察其颜色 |
C、 装置可证明非金属性Cl>C>Si |
D、 装置向左推动针筒活塞可检验该装置的气密性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 粒子 | I2 | Br2 | IO
| ||
| 物质的量/mol | 0.5 | 1.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com