
| A. | 中子数为20的氯原子:${\;}_{17}^{35}$Cl | B. | 二氧化硅的分子式:SiO2 | ||
| C. | 硫化氢的结构式:H-S-H | D. | 氯化铵的电子式: |
分析 A.元素符号的左上角标质量数,质量数=质子数+中子数;
B.二氧化硅晶体为原子晶体,不存在二氧化硅分子;
C.用短线代替所有共用电子对即为结构式;
D.氯化铵为离子化合物,氯离子需要标出最外层电子及所带电荷.
解答 解:A.氯元素的质子数为17,中子数为20的氯原子的质量数为37,该原子正确的表示方法为:1737Cl,故A错误;
B.SiO2为二氧化硅的化学式,二氧化硅不存在分子式,故B错误;
C.硫化氢分子中含有2个S-H键,其结构式为:H-S-H,故C正确;
D.NH4Cl为离子化合物,N原子最外层5个电子,Cl原子最外层7个电子,则其电子式为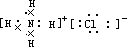 ,故D错误;
,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、结构式、元素符号等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热△H=-241.8KJ/mol | |
| B. | 相同条件下,充分燃烧1molH2(g)与1molS(g)的混合物比充分燃烧1mol H2S(g)放热多20.1kJ | |
| C. | 由①②知,水的热稳定性小于硫化氢 | |
| D. | ②中生成固态硫,△H将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化学键 | S=O(SO2) | O=O(O2) | S=O(SO3) |
| 能量/KJ | 535 | 496 | 472 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (R,R′为烃基或氢)
(R,R′为烃基或氢) (R,R′为烃基)
(R,R′为烃基)
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )为原料合成某重要的有机物X、Y,路线如下(部分反应条件略):
)为原料合成某重要的有机物X、Y,路线如下(部分反应条件略):



 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D四种短周期元素的核电荷数依次增大.A原子s轨道电子数是p轨道电子数的两倍,C原子的L能层中有两对成对电子,C、D同主族. E、F是第四周期元素,且E位于周期表中ds区,F原子核外有33种不同运动状态的电子.根据以上信息用相应的元素符号填空:
已知A、B、C、D四种短周期元素的核电荷数依次增大.A原子s轨道电子数是p轨道电子数的两倍,C原子的L能层中有两对成对电子,C、D同主族. E、F是第四周期元素,且E位于周期表中ds区,F原子核外有33种不同运动状态的电子.根据以上信息用相应的元素符号填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 我国本土科学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )
我国本土科学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )| A. | 与乙醇发生酯化反应生成产物的分子式为C8H18O4 | |
| B. | 能发生加成反应,不能发生取代反应 | |
| C. | 在铜的催化下与氧气反应的产物可以发生银镜反应 | |
| D. | 标准状况下1mol该有机物可以与足量金属钠反应产生22.4L H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com