
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计] 控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。
实验编号 | 实验目的 | T/K | pH | c/10-3 mol·L-1 | |
H2O2 | Fe2+ | ||||
① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
② | 探究温度对降解反应速率的影响 |
|
|
|
|
③ |
| 298 | 10 | 6.0 | 0.30 |

[数据处理] 实验测得p-CP的浓度随时间变化的关系如上图。
(2)请根据上图实验①曲线,计算降解反应50~150 s内的反应速率:
v(p-CP)=________mol·L-1·s-1。
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:_____________________________
(4)实验③得出的结论是:pH等于10时,________。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:________。
(1)
实验编号 | 实验目的 | T/K | pH | c/10-3 mol·L-1 | |
H2O2 | Fe2+ | ||||
① | 探究温度对降解反应速率的影响 | 313 | 3 | 6.0 | 0.30 |
③ | 探究溶液的pH对降解反应速率的影响 |
|
|
|
|
(2)8.0×10-6
(3)H2O2在温度过高时迅速分解
(4)反应不能进行
(5)在溶液中加入碱溶液,使溶液的pH大于或等于10(其他合理答案均可)
【解析】(1)依题意可知②的实验温度为313 K,实验对比是建立在其它条件相同前提下,故pH应与①的相同。若改变pH,其它条件不变可探究溶液pH对反应速率的影响。
(2)实验①曲线中,50~150 s时。
Δc(p-CP)=1.2×10-3 mol·L-1-0.4×10-3 mol·L-1=0.8×10-3 mol·L-1,所以v(p-CP)==8.0×10-6 mol·L-1·s-1。
(3)在降解反应中,H2O2新产生的自由基起氧化作用,温度过高,H2O2因热稳定性差而分解,导致降解反应速率下降。
(4)由双曲线③可知,pH=10时,c(p-CP)基本不变,反应趋于停止。
(5)由(4)得到启示:在pH=10溶液中,反应速率趋于零,可将所取样加入NaOH溶液中(使pH=10);化学反应速率随温度降低而降低,故亦可用迅速大幅降温法。


科目:高中化学 来源:2014年高中化学鲁科版选修四第3章 物质在水溶液中的行为练习卷(解析版) 题型:选择题
100℃时,水的离子积为1×10-12 mol2·L-2,若该温度下某溶液中的H+浓度为1×10-7 mol·L-1,则该溶液是( )
A.酸性 B.碱性C.中性 D.无法判断
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四模块综合检测练习卷(解析版) 题型:选择题
铜锌原电池(如图)工作时,下列叙述正确的是( )
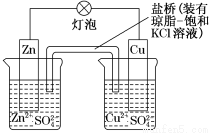
A.正极反应为:Zn―→Zn2++2e-
B.电池反应为:Zn+Cu2+=Zn2++Cu
C.在外电路中,电子从正极流向负极
D.盐桥中的K+移向ZnSO4溶液
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题3 溶液中的离子反应练习卷(解析版) 题型:选择题
将pH=6的CH3COOH溶液加水稀释1000倍后,溶液中的( )
A.pH=9 B.c(OH-)≈10-5 mol·L-1
C.pH≈7 D.c(OH-)<10-7 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题3 溶液中的离子反应练习卷(解析版) 题型:选择题
下列关于溶液的酸碱性,说法正确的是( )
A.pH=7的溶液是中性
B.中性溶液中一定:c(H+)=1.0×10-7 mol·L-1
C.c(H+)=c(OH-)的溶液呈中性
D.在100°C时,纯水的pH<7,因此显酸性
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题2 反应速率与化学平衡练习卷(解析版) 题型:选择题
在恒容密闭容器中通入A、B两种气体,在一定条件下发生反应:
2A(g)+B(g)  2C(g) ΔH>0。
2C(g) ΔH>0。
达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( )
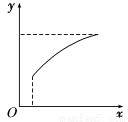
选项 | x | y |
A | 再通入A | B的转化率 |
B | 加入催化剂 | A的体积分数 |
C | 压强 | 混合气体的总物质的量 |
D | 温度 | 混合气体的总物质的量 |
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题2 反应速率与化学平衡练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题1 化学反应与能量变化练习卷(解析版) 题型:选择题
某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
A.正极反应式为:O2+2H2O+4e-=4OH-
B.工作一段时间后,电解液中KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2=2H2O
D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
查看答案和解析>>
科目:高中化学 来源:2014年高中化学人教版选修四第二章 化学反应速率与化学平衡练习卷(解析版) 题型:选择题
有一反应:2A+B 2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有 a、b、c三点,如图所示,则下列描述正确的是( )
2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有 a、b、c三点,如图所示,则下列描述正确的是( )
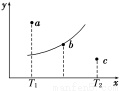
A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下若由a点达到平衡,可以采取增大压强的方法
D.c点:v(正)<v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com