
a mol FeS与b mol FeO投入V L、c mol·L-1的稀硝酸溶液中充分反应,产生NO气体,
所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
①(a+b)×63 g ②(a+b)×189 g
③(a+b) mol ④(cV-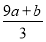 ) mol
) mol
A.①④ B.②③ C.①③ D.②④
D
【解析】涉及氧化还原反应的知识往往是多种守恒原理的综合运用。本题综合运用原子守恒与电子得失守恒来求解。从题中叙述可知,该反应的产物主要有三种:Fe(NO3)3、H2SO4和NO,其中Fe(NO3)3中硝酸根离子的物质的量等于未被还原的硝酸的物质的量,由原子守恒得出生成的Fe(NO3)3的物质的量为(a+b) mol,则未被还原的硝酸的物质的量为3(a+b) mol,再乘以硝酸的摩尔质量可得出②是正确的。该反应中生成的NO是还原产物,a mol FeS被氧化失去9a mol电子,b mol FeO被氧化失去b mol电子,由得失电子守恒可知生成NO的物质的量为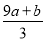 mol,再结合原子守恒可得出④是正确的。
mol,再结合原子守恒可得出④是正确的。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014年高考化学二轮复习专题滚动练2 化学基本理论练习卷(解析版) 题型:填空题
按如图所示装置连接,X、Y均为惰性电极。请回答下列问题:
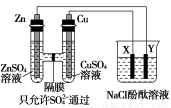
(1)Zn为________极。
(2)连接好装置后,烧杯中的溶液发生反应的离子方程式是___________。
(3)图中通过隔膜的SO42-向________(填“左”“右”或“不”)迁移,Y极及其附近出现的现象是________。
(4)常温下,当Zn极质量减少32.5 g时,X极生成气体8.4 L(标准状况),若此时烧杯中溶液的体积为500 mL,则此时烧杯中溶液的pH=________(不考虑生成的气体溶于水)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷二(解析版) 题型:选择题
下列各组中的反应,属于同一反应类型的是( )
A.由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C.由氯代环己烷消去制环己烯;由丙烯加溴制1,2?二溴丙烷
D.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷一(解析版) 题型:填空题
“氢能”是人类未来最理想的新能源之一。
(1)实验测得,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则表示氢气燃烧热的热化学方程式为__________________________。
(2)利用核能把水分解制氢气,是目前正研究的课题。如图是其中的一种流程,流程中用了过量的碘(提示:反应②的产物是O2、SO2和H2O)。
完成下列反应的化学方程式:反应①________________;反应②________________。此法制取氢气的最大优点是____________________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷一(解析版) 题型:填空题
X、Y、Z、Q、W、R六种短周期元素原子序数依次增大。化合物甲由X、Z、Q三种元素组成,常温下0.1 mol/L甲溶液的pH=13。工业上常用电解饱和QR溶液生成甲;化合物乙由X、R两种元素组成。请回答下列问题:

(1)Q的原子结构示意图为________。
(2)Y元素的单质能发生如图所示的转化,则Y元素为________(填元素符号)。
在甲溶液中通入足量YZ2气体,所得溶液呈碱性,原因是__________________(用离子方程式和必要的文字说明)。
(3)W的单质既能与甲溶液反应,又能与乙溶液反应。
①常温下,将W的单质和甲溶液混合,发生反应的离子方程式为______________________________________________________________________________;
②Q、W两种元素金属性的强弱为Q________W(填“<”或“>”),下列表述中能证明这一事实的是________(填序号)。
a.Q单质的熔点比W单质的低
b.Q的最高价氧化物的水化物的碱性比W的最高价氧化物的水化物的碱性强
c.W的原子序数大
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷一(解析版) 题型:选择题
常温下,向20 L的真空容器中通入a mol H2S和b mol SO2(a和b都是正整数,且a≤5,b≤5)。反应完全后,容器内气体可能达到的最大密度是( )
A.24.5 g/L B.14.4 g/L C.8 g/L D.5.19 g/L
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练9-2练习卷(解析版) 题型:填空题
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当 铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答 下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当 铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答 下列问题。
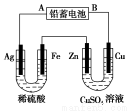
(1)A是铅蓄电池的 极,铅蓄电池正极反应式为 ,放电过程中电解液的密度 (填“减小”、“增大”或“不变”)。
(2)Ag电极的电极反应式是 ,该电极的电极产物共 g。
(3)Cu电极的电极反应式是 ,CuSO4溶液的浓度 (填“减小”、“增大”或“不变”)
(4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示 。

a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练9-1练习卷(解析版) 题型:选择题
研究人员最近发明了一种“水”电池,这种电池能利用淡水和海水之间含盐量差别进行发电,在海水中电流总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是( )
A.正极反应式:Ag+Cl--e-=AgCl
B.每生成1 mol Na2Mn5O10转移2 mol电子
C.Na+不断向“水”电池的负极移动
D.AgCl是还原产物
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-2练习卷(解析版) 题型:填空题
中学化学实验中,淡黄色的pH试纸常用于测定溶液的酸碱性。在25 ℃时,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色。而要精确测定溶液的pH,需用pH计。pH计主要通过测定溶液中H+浓度来测定溶液的pH。
(1)已知水中存在平衡:H2O H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是 (填字母)。
H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是 (填字母)。
A.向水中加入NaHSO4
B.向水中加入Cu(NO3)2
C.加热水至100 ℃[其中c(H+)=1×10-6 mol·L-1]
D.在水中加入(NH4)2SO4
(2)现欲测定100 ℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显 色,溶液呈 性(填“酸”、“碱”或“中”);若用pH计测定,则pH 7(填“>”、“<”或“=”),溶液呈 性(填“酸”、“碱”或“中”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com