
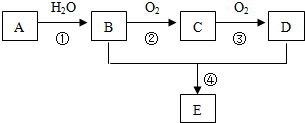
分析 A 是一种分子量为28的气态烃,A是乙烯,其结构简式为CH2=CH2,
乙烯和水发生加成反应生成乙醇,B的结构简式为CH3CH2OH,
乙醇被氧化生成乙醛,C为CH3CHO,
乙醛被氧化生成乙酸,D为CH3COOH,
乙醇和乙酸发生酯化反应生成乙酸乙酯,E为CH3COOCH2CH3,根据有机物的结构和性质分析解答.
解答 解:A 是一种分子量为28的气态烃,也是一种重要的化工原料,A是乙烯,其结构简式为CH2=CH2,
乙烯和水发生加成反应生成乙醇,B的结构简式为CH3CH2OH,
乙醇被氧化生成乙醛,C为CH3CHO,
乙醛被氧化生成乙酸,D为CH3COOH,
乙醇和乙酸发生酯化反应生成乙酸乙酯,E为CH3COOCH2CH3,
(1)A为CH2=CH2,与水发生加成反应,故答案为:加成反应;
(2)E为CH3COOCH2CH3,故答案为:CH3COOCH2CH3;
(3)反应②是乙醇被氧化物乙醛,反应方程式为:2CH3CH2OH+O2 $→_{△}^{催化剂}$2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2 $→_{△}^{催化剂}$2CH3CHO+2H2O.
点评 本题以乙烯为载体考查的有机物推断,明确官能团及其性质是解有机推断题的关键,根据乙烯、乙醇、乙醛、乙酸、乙酸乙酯之间的转化关系来分析解答即可,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
 实验室需要0.1mol/L NaOH溶液450mL,需要0.5mol/L硫酸溶液500mL.根据这两种溶液的配置情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL,需要0.5mol/L硫酸溶液500mL.根据这两种溶液的配置情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| B. | 常温下,21gC3H6和C4H8的混合物中含有的碳原子数为1.5NA | |
| C. | 46g乙醇中含有C-H键的数目为6NA | |
| D. | 常温下,2.7g金属铝与足量浓度为18mol/L的浓硫酸反应时转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑥ | B. | ④⑤⑥ | C. | ②③④ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
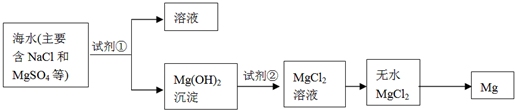


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②③ | B. | 只有①②③④ | C. | 只有①③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 阴离子的还原性:Y>X | |
| B. | Y和Z的简单阴离子都会破坏水的电离平衡 | |
| C. | 最高价氧化物的水化物的酸性:Z>Y | |
| D. | 氢化物的热稳定性:W>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
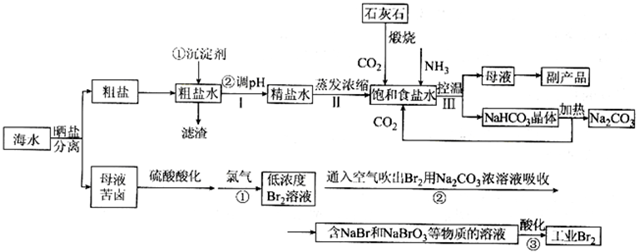
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com