
����Ŀ������������SnSO4����һ����Ҫ�������Σ���Ҫ���ڵ�ƹ�ҵ�Ķ��������Ͻ�����������ɫ��ӡȾ��ҵ��ýȾ����˫��ˮȥ�����ȡ�ij�о�С�����SnSO4�Ʊ�·�����£� 
�������ϣ�
��.���������£�����ˮ��Һ����Sn2+��Sn4+������Ҫ������ʽ��Sn2+�ױ�������
��.SnCl2��ˮ������������Sn(OH)Cl����ʽ�Ȼ���������
III.Sn(OH)2��������Al(OH)3�������ơ� ��ش��������⣺
��1��SnCl2��ĩ���Ũ��������ܽ⣬����������ԭ����_________________��
��2����Ӧ��õ�������SnO���õ��ó��������ӷ���ʽ�� ________________��
��3���ڷ�Ӧ��õ�����SnO��Ҫ���С����ˡ�Ưϴ���IJ���������SnO�Ƿ�ϴ�ɾ��IJ�����_______����ҺI���ʵijɷ���______����д��ѧʽ����
��4�����������£�SnSO4����������˫��ˮȥ������������Ӧ�����ӷ���ʽ��_______________��
��5����Ӧ��֮��ġ�������������_______��_______�����ˡ�ϴ�ӡ����¸��
��6����С��ͨ�����з���������������Ʒ�Ĵ��ȣ����ʲ����뷴Ӧ����
�ٽ��������������У������ķ�ӦΪ��Sn + 2HCl=SnCl2+ H2����
�ڼ��������FeCl3��
������֪Ũ�ȵ�K2Cr2O7�ζ����ɵ�Fe2+�������ķ�ӦΪ��6FeCl2+ K2Cr2O7+ 14HCl =6FeCl3+ 2KCl + 2CrCl3+7H2O��ȡ1. 226 g ������Ʒ��������������Ӧ����ȥ0.1000 mol/L K2Cr2O7��Һ32.00 mL�����������Ʒ����������������_______________��
���𰸡� �������ᣬʹˮ��ƽ�������ƶ�������SnCl2ˮ�� Sn2++CO32���TSnO��+CO2�� ȡ���һ��ϴ��Һ���������Թ��У����������ữ����������Һ����������ʵ��������֤��ϴ�Ӹɾ� NaCl��Na2CO3 Sn2++H2O2+2H+�TSn4++2H2O ����Ũ�� ��ȴ�ᾧ 93.18��
������������Ϣ����.���������£�����ˮ��Һ����Sn2+��Sn4+������Ҫ������ʽ��Sn2+�ױ�������SnCl2��ĩ��Ũ��������ܽ�õ�������Һ����ʱ��Һ�к���Sn2����Sn4���������м���Sn�ۣ�Sn�ۿ��Ժ�H��������Ӧ��ʹ��Һ���Լ�������������ҺpHֵ������Sn���Խ����������ɵ�Sn4����ԭ��Sn2��������ֹSn2��������ΪSn4�������˵�SnCl2��Һ�������м�̼���ƣ���SnԪ����SnO��ʽ����������ϴ�ӵô�����SnO����ϡ���ᣬ��SnSO4��Һ������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӣ��Ƶ�SnSO4���壻
��1������Ϣ����.SnCl2��ˮ������������Sn(OH)Cl����ʽ�Ȼ���������SnCl2��ˮ�з���ˮ�ⷴӦ��SnCl2+H2O![]() Sn��OH��Cl+HCl������������Sn��OH��Cl����Һ�������ʣ�������HCl��ƽ�����淴Ӧ�����ƶ�������Sn2��ˮ�⣻��2����Ӧ��õ�������SnO���õ��ó��������ӷ���ʽ��Sn2++CO32���TSnO��+CO2������3����Ӧ��Ϊ��SnCl2��Һ�м�̼���ƣ��õ��ij���ΪSnO���ó��������˺��渽����Cl����Ҫ����������Ƿ�ϴ�Ӹɾ���ֻҪ�������һ��ϴ��Һ���Ƿ���Cl����������ȡ���һ��ϴ��Һ�������м���AgNO3��Һ������������˵����ϴ�Ӹɾ�����4�����������£�SnSO4����������˫��ˮȥ��������SnSO4�����������º�˫��ˮ��Ӧ��Sn2���л�ԭ�ԣ�˫��ˮ�������ԣ�����Ӧ���ǣ�Sn4����H2O������ʽΪ��Sn2��+H2O2+2H��=Sn4��+2H2O����5����Ӧ���Ѿ��õ�SnSO4��Һ������Һ�õ�����ķ���������Ϊ������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӣ���6���٢ڢ۷����ķ�Ӧ�ֱ�ΪSn+2HCl=SnCl2+H2���٣�SnCl2+2FeCl3=SnCl4+2FeCl2�ڣ�6FeCl2+K2Cr2O7+14HCl=6FeCl3+2KCl+2CrCl3+7H2O�ۣ��ɷ���ʽ�٢ڢ۵�֪K2Cr2O7��6FeCl2��3SnCl2��3Sn��n��Sn��=3n��K2Cr2O7��=3��0.1000mol��L��1��0.032L=0.0096mol��m��Sn��=n��Sn����M��Sn��=0.0096mol��119g��mol��1=1.1424g��������Ʒ��������������=m(Sn)/m(��Ʒ)��100%=1.1424g/1.226g��100%=93.18%����������Ʒ����������������93.18%��
Sn��OH��Cl+HCl������������Sn��OH��Cl����Һ�������ʣ�������HCl��ƽ�����淴Ӧ�����ƶ�������Sn2��ˮ�⣻��2����Ӧ��õ�������SnO���õ��ó��������ӷ���ʽ��Sn2++CO32���TSnO��+CO2������3����Ӧ��Ϊ��SnCl2��Һ�м�̼���ƣ��õ��ij���ΪSnO���ó��������˺��渽����Cl����Ҫ����������Ƿ�ϴ�Ӹɾ���ֻҪ�������һ��ϴ��Һ���Ƿ���Cl����������ȡ���һ��ϴ��Һ�������м���AgNO3��Һ������������˵����ϴ�Ӹɾ�����4�����������£�SnSO4����������˫��ˮȥ��������SnSO4�����������º�˫��ˮ��Ӧ��Sn2���л�ԭ�ԣ�˫��ˮ�������ԣ�����Ӧ���ǣ�Sn4����H2O������ʽΪ��Sn2��+H2O2+2H��=Sn4��+2H2O����5����Ӧ���Ѿ��õ�SnSO4��Һ������Һ�õ�����ķ���������Ϊ������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӣ���6���٢ڢ۷����ķ�Ӧ�ֱ�ΪSn+2HCl=SnCl2+H2���٣�SnCl2+2FeCl3=SnCl4+2FeCl2�ڣ�6FeCl2+K2Cr2O7+14HCl=6FeCl3+2KCl+2CrCl3+7H2O�ۣ��ɷ���ʽ�٢ڢ۵�֪K2Cr2O7��6FeCl2��3SnCl2��3Sn��n��Sn��=3n��K2Cr2O7��=3��0.1000mol��L��1��0.032L=0.0096mol��m��Sn��=n��Sn����M��Sn��=0.0096mol��119g��mol��1=1.1424g��������Ʒ��������������=m(Sn)/m(��Ʒ)��100%=1.1424g/1.226g��100%=93.18%����������Ʒ����������������93.18%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��2CH3COCH3(l)![]() CH3COCH2COH(CH3)2(l)��ȡ����CH3COCH3���ֱ���0 ����20 ���£������ת������ʱ��仯�Ĺ�ϵ����(Yt)����ͼ��ʾ������˵����ȷ����
CH3COCH2COH(CH3)2(l)��ȡ����CH3COCH3���ֱ���0 ����20 ���£������ת������ʱ��仯�Ĺ�ϵ����(Yt)����ͼ��ʾ������˵����ȷ����
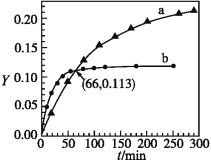
A��b����0 ����CH3COCH3��Yt����
B����Ӧ���е�20 minĩ��CH3COCH3��![]() >1
>1
C�������¶ȿ����̷�Ӧ��ƽ���ʱ�䲢�����ƽ��ת����
D����Y=0��Y=0.113��CH3COCH2COH(CH3)2��![]() =1
=1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʣ������Ը��������Һ����ˮ�����������
A.���ͼױ�B.1����ϩ�Ͷ��ױ�
C.����1����ϩD.����ͱ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ����ȫ���������ϸ���Ĵ���Ԫ�ص���(����)
A. P��N��Mn��K B. Fe��S��P��N
C. N��S��Ca��P D. Fe��Mn��B��Mo
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ӣ���ǿ������Һ�п��Դ����������
A. Mg2+ ��Fe3+ ��SCN-�� Cl- B. Na+��K+��NO3- Ba2+
C. Na+ ��AlO2- ��HCO3- ��SO42- D. Fe2+ ��I- ��NO3- ��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������仯���ǣ� ��
A. ����ɫ����¶���ڿ����б���䰵B. ��������Һ�м��뱥���������Һ
C. ��ɫ����ͭ�����м���Ũ����D. ʯī��һ��������ת���ɽ��ʯ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���£���̬���ӶϿ�1mol ��ѧ�����ʱ��Ϊ���ʡ���֪H-H��H-O��O=O���ļ�����H�ֱ�Ϊ436kJ/mol��463kJ/mol��495kJ/mol�������Ȼ�ѧ����ʽ��ȷ����
A. H2O(g)=H2(g)+1/2O2(g) ��H =-485kJ/mol
B. H2O(g)=H2(g)+1/2O2(g) ��H =+485kJ/mol
C. 2H2(g)+O2(g)=2H2O(g) ��H =+485kJ/mol
D. 2H2(g)+O2(g)=2H2O(g) ��H =-485kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ���ܷ��γ�ԭ��أ����ܣ��ֱ�д��ԭ��صĵ缫��Ӧʽ�� 
��1������Ϊ �� �缫��ӦʽΪ �� ����Ϊ �� �缫��ӦʽΪ��
��2������������������ �� ����Ӧ��������0.2mol���ӷ���ת�ƣ������ɵ�ͭ������Ϊ �� ��Cu�����ԭ��������64��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ϡ��Һ�У��������кͷ�Ӧ����1 molˮʱ�ķ�Ӧ�Ƚ����к�������������ͼװ�ý����к��ȵIJⶨ����ش��������⣺

��1��ͼʾװ����������Ҫ��ɲ���δ������������ �� ��
��2���ձ�����������ĭ���ϵ������� ��
��3��������ʱ�ּ���ע�뷴ӦҺ����õķ�Ӧ����ֵ ���ƫ��ƫС������Ӱ�족����
��4����һ���������к��Ȳⶨʵ�飬�¶ȼ���ʹ�� �Ρ�
��5����ȡ0.5 mol/L�������0.55 mol/L��NaOH��Һ��50 mL����ʵ�飬��������NaOH��Һ��ʼƽ���¶�Ϊt1������Ϸ�Ӧ������¶�Ϊt2��������Һ�ܶȾ�Ϊ1 g/mL��������Һ�ı�����c= 4.18 J/g��������ʽ�����к��ȣ���H= kJ/mol�����û���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com