
| A. | 升温,逆反应速率减小 | B. | 加压,H2浓度减小 | ||
| C. | 增加H2,K减小 | D. | 该反应的正反应是吸热反应 |
分析 由K可知,反应为CO2(g)+H2(g)?H2O(g)+CO(g),升高温度,H2浓度减小,可知升高温度平衡正向移动,正反应为吸热反应,以此来解答.
解答 解:A.升高温度,正逆反应速率均增大,故A错误;
B.由K可知反应为CO2(g)+H2(g)?H2O(g)+CO(g),反应前后气体体积不变,则加压平衡不移动,且氢气浓度增大,故B错误;
C.增加H2,平衡正向移动,K与温度有关,则K不变,故C错误;
D.升高温度,H2浓度减小,可知升高温度平衡正向移动,正反应为吸热反应,故D正确;
故选D.
点评 本题考查化学平衡常数的含义,为高频考点,把握K与反应和温度的关系、平衡移动为解答的关键,侧重分析与应用能力的考查,注意K为生成物浓度幂之积与反应物浓度幂之积的比,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
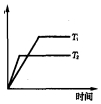 研究表明,在CuZnO2催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
研究表明,在CuZnO2催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2(OH)2CO3 $\stackrel{H_{2}SO_{4}}{→}$ CuSO4(aq)$\stackrel{Na}{→}$Cu | |
| B. | 饱和食盐水$\stackrel{NH_{3}+CO_{2}}{→}$NaHCO3 $\stackrel{△}{→}$Na2CO3 | |
| C. | 海水$\stackrel{熟石灰}{→}$ Mg(OH)2 $\stackrel{△}{→}$ MgO $\stackrel{电解}{→}$ Mg | |
| D. | NH3 $→_{催化剂,△}^{O_{2}}$ N2 $\stackrel{O_{2}+H_{2}O}{→}$HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验步骤 | 现象 | 结论 | |
| A | 取待测液,滴加酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | 待测液中可能含Fe2+ |
| B | 将待测气体通入品红溶液中,稍后加热溶液 | 开始品红溶液褪色,加热后又变为红色 | 待测气体中肯定含SO2 |
| C | 取待测液,滴加硝酸酸化的 BaCl2溶液 | 生成白色沉淀 | 待测液中可能含Ag+ |
| D | 将湿润的KI淀粉试纸较长时间置于待测气体中 | 取出后没有观察到试纸变色 | 待测气体中肯定不含Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

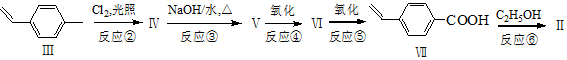
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,Na2O2与N2和CO2组成的混合气体反应生成0.5mol O2时,转移电子数是2NA | |
| B. | 标准状况下,11.2 L的甲醇所含的氢原子数等于2NA | |
| C. | 电解饱和食盐水,阳极产生22.4 L气体时,电路中通过的电子数目为2NA | |
| D. | 1L 1 mol/L CuCl2溶液中含有的氯离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com