
 短周期元素A~E在元素周期表的相对位置如图,下列判断错误
短周期元素A~E在元素周期表的相对位置如图,下列判断错误| A、单核阴、阳离子半径大小顺序为E>A>B | B、元素C、D、E的最高价氧化物水化物的酸性依次增强 | C、用惰性电极电解含等浓度的D、E单核阴离子溶液,先得到单质D | D、A、D的氢化物各1 mol发生分解反应,前者吸收的热量较少 |


科目:高中化学 来源: 题型:
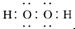
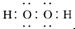
查看答案和解析>>
科目:高中化学 来源: 题型:
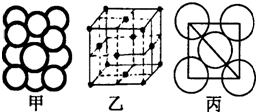 A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负极最小的元素.
A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负极最小的元素.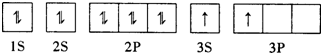
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元 素 描 述 |
| A | 人体内含量最多的元素,且其单质是常见的助燃剂 |
| B | 形成化合物种类最多的元素 |
| C | 短周期中,单质的导电性最强 |
| D | 单质是最轻的气体,也是目前最清洁的能源 |
| E | 是日常生活中接触最多的过渡金属元素,密度为7.8g/cm3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com