
【题目】有0.5mol某元素的单质直接与氯气反应后,质量增加了17.75g,该元素是
A.AlB.KC.FeD.Zn
科目:高中化学 来源: 题型:
【题目】硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下: ①配制混酸:组装如图反应装置.取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中.把18 mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50﹣60℃下发生反应,直至反应结束.
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.已知
(i) ![]() +HNO3(浓)
+HNO3(浓) ![]()
![]() +H2O
+H2O 
(ii)可能用到的有关数据列表如下
物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/gcm﹣3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
1,3﹣二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |

请回答下列问题:
(1)配置混酸应先在烧杯中先加入 .
(2)恒压滴液漏斗的优点是 .
(3)实验装置中长玻璃管可用代替(填仪器名称).
(4)反应结束后产品在液体的层(填“上”或者“下”),分离混酸和产品的操作方法为
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? .
(6)为了得到更纯净的硝基苯,还须先向液体中加入除去水,然后蒸馏,最终得到17.5g硝基苯,则硝基苯的产率为(保留两位有效数字).若加热后,发现未加沸石,应采取的操作是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢叠氮酸(HN3)及其盐(如NaN3、NH4N3、CuN3等)都具有爆炸性,最近南京理工大学胡丙成教授团队成功合成出PHAC,其化学式为(N3)6(H3O)3(NH4)4Cl。回答下列问题:
(1)PHAC中“N3”的化合价为______。N2F2的电子式为_______。
(2)汽车安全气囊中的NaN3可发生下列反应:
NaN3(s)=Na(s)+3/2N2(g) △H1;
2NaN3(s)+CuO(s)=Na2O(s)+3N2(g)+Cu(s) △H1;
则反应CuO(s)+2Na(s)=Na2O(s)+Cu(s) △H=_______(用△H1和△H2表示)
(3)25℃时,将lmolNH4N3投入一2L的恒容密闭容器中,0.5min后反应达到平衡,测得生成的两种单质的物质的量之和为1.6mol, 则NH4N3的平衡转化率为_______,25℃时该反应的平衡常数K=________。
(4)氢叠氮酸(HN3)易溶于水,且酸性与醋酸相近。
①HN3在水溶液中的电离方程式为_______________.
② 0.1mol/L的HN3溶液与0.1mol/L的NaN3等体积混合,混合溶液中各离子浓度由大到小的顺序为__________________。
③ 已知T℃时,Ksp(CuN3)=5.0×10-9,Ksp(Cu2S)=2.5×10-48,则相同温度下反应:
Cu2S(s)+2N3-(aq)![]() 2CuN3(s)+S2-(aq)的平衡常数K=_________.
2CuN3(s)+S2-(aq)的平衡常数K=_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂有一个氯气钢瓶发生损坏,造成氯气泄漏。下列处理钢瓶的方法较合理的是
A.把钢瓶丢到深坑中,用石灰掩埋B.把钢瓶推到小河中
C.把钢瓶抬到下风口的地方并遗弃D.把钢瓶抬到上风口的地方并遗弃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能源与能量的说法正确的是( )
A.煤和石油是经过亿万年形成的,亿万年后煤和石油还会生成,故二者属可再生能源
B.蒸汽属于一次能源
C.凡经过加热而发生的反应都是吸热反应,常温下进行的反应都是放热反应
D.反应物和生成物的总能量决定反应是放热还是吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“千年大计、国家大事”,雄安新区无疑是今年最受瞩目的地区。不过,近日媒体报道河北廊坊、天津等地存在超大规模的工业污水渗坑,给雄安新区的水环境带来隐患,目前正采用多种方法对污水进行处理,改善水资源状况。
(1)在微生物作用的条件下,废水中的NH4+经过两步反应氧化成NO3-,两步反应的能量变化示意图如下:
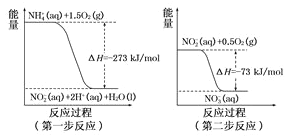
①第一步反应是______反应(选填“放热”或“吸热”),判新依据是_________。1mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式为_____________。
②一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该过程中CH3OH反应生成CO2,则参加反应的还原剂和氧化剂的物质的量之比为______.
(2)二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,是国际上公认为安全、无毒的绿色消毒剂,可以投入废水中清除污染物。
①二氧化氯可以将废水中的氰化物(CN-)氧化成两种无污染气体.写出离子方程式________。
②废水中的重金属离子的危害性很大,二氧化氯能够在弱酸性溶液中把二价锰离子氧化成不溶于水的二氧化锰(MnO2),写出反应的离子方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.0.1molCl2常温下与过量稀NaOH溶液反应转移电子总数为0.1NA
B.25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH﹣数目为0.2NA
C.标准状况下,22.4LCHCl3含有的分子数为NA
D.1L 0.1molL﹣1的硫化钠溶液中硫离子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定能够鉴定卤代烃中卤元素的存在的操作是( )
A.在卤代烃中直接加入AgNO3溶液
B.加蒸馏水,充分搅拌后,加入AgNO3溶液
C.加入NaOH溶液,加热后加入稀硝酸酸化,再加入AgNO3溶液
D.加入NaOH的乙醇溶液,加热后加入AgNO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com