
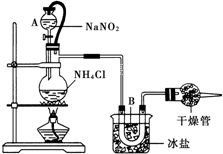
 实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净氮气,如图.反应式为:NaNO2+NH4Cl═NaCl+N2↑+2H2O;反应放热.试回答:
实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净氮气,如图.反应式为:NaNO2+NH4Cl═NaCl+N2↑+2H2O;反应放热.试回答:

科目:高中化学 来源: 题型:
| 污染指数 | 首要污染物 | 空气质量级别 | 空气 质量状况 | ||
| 二氧化硫 | 二氧化氮 | 可吸入颗粒物 | |||
| 12 | 33 | 66 | 2 | 良 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、装修新房季节最好选择夏季 |
| B、适度开窗通风,充分地进行内外空气对流 |
| C、用高浓度的甲醛对室内环境消毒 |
| D、在各个房间内均匀的放置适量的吊兰、芦荟等鲜花 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol?L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
| N2 | H2 | NH3 | |
| 起始浓度(mol/L) | 0.2 | 0.3 | 0.2 |
| 平衡浓度(mol/L) | a | b | c |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO在平衡时转化率为10% |
| B、平衡浓度c(CO2)=c(H2) |
| C、平衡时气体平均相对分子质量约为23.3 |
| D、其他条件不变时,缩小体积,H2O(g)的转化率随之降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应放出热量x=0.05a |
| B、反应达到平衡状态时,2v(SO2)消耗=v(O2)生成 |
| C、若恒温恒压下,在10L的密闭容器中加入0.1mol SO2和0.05mol O2,平衡后反应放出的热量y kJ,则y<x |
| D、升高温度,平衡常数变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| A、该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变 |
| B、因该反应熵变(△S)大于0,焓变(△H)大于0,所以在低温下自发进行 |
| C、根据表中数据,计算15.0℃时的分解平衡常数约为2.0×10-9(mol?L-1)3 |
| D、达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com