
分析 X、Y、Z、W均为1~18号元素,它们的原子序数依次增大.X和Y可形成常见化合物YX4,一个YX4分子中电子总数为10,则Y为C元素、X为H元素;W原子的最外层电子数是核外电子总数的$\frac{3}{4}$,原子只能有2个电子层,设最外层电子数为a,则(2+a)×$\frac{3}{4}$=a,故a=6,则W为O元素;Z单质在通常状况下为无色无味气体,原子序数介于碳、氧之间,故Z为N元素,据此解答.
解答 解:X、Y、Z、W均为1~18号元素,它们的原子序数依次增大.X和Y可形成常见化合物YX4,一个YX4分子中电子总数为10,则Y为C元素、X为H元素;W原子的最外层电子数是核外电子总数的$\frac{3}{4}$,原子只能有2个电子层,设最外层电子数为a,则(2+a)×$\frac{3}{4}$=a,故a=6,则W为O元素;Z单质在通常状况下为无色无味气体,原子序数介于碳、氧之间,故Z为N元素.
(1)由H、N、O三种元素可以组成一种盐,该盐是常用速效化肥,该盐为硝酸铵,由于铵根离子水解:NH4++H2O?NH3•H2O+H+,不宜与碱性肥料混合或在碱性土壤中施用,
故答案为:NH4++H2O?NH3•H2O+H+;
(2)由H、C、N、O四种元素可以组成多种化合物,其中既能与盐酸又能与烧碱溶液反应的无机物是NH4HCO3等,有机物是H2NCH2COOH等,
故答案为:NH4HCO3;H2NCH2COOH;
(3)1.2gC的物质的量=$\frac{1.2g}{12g/mol}$=0.1mol,根据碳原子守恒得n(CO2)=n(C)=0.1mol,n(NaOH)=1mol/L×0.15L=0.15mol,1<n(NaOH):n(CO2)<2,所以二氧化碳和氢氧化钠反应后的溶液中存在碳酸钠和碳酸氢钠,设n(Na2CO3)=xmol,n(NaHCO3)=ymol,根据钠原子和碳原子守恒得:$\left\{\begin{array}{l}{x+y=0.1}\\{2x+y=0.15}\end{array}\right.$,解得$\left\{\begin{array}{l}{x=0.05}\\{y=0.05}\end{array}\right.$,根据物料守恒知c(Na+)最大,碳酸根、碳酸氢根水解,溶液呈碱性,故c(OH-)>c(H+),水解程度都很小,且碳酸根水解程度大于碳酸氢根,则离子浓度大小顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
点评 本题考查位置结构性质的相互关系,正确推断元素是解本题关键,是对学生综合能力考查,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
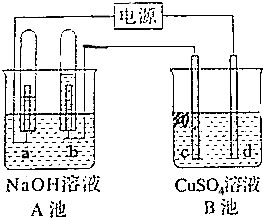 如图所示,A池用石墨电极电解pH=13的Na0H溶液100mL,B池为模拟电解精炼铜的装置,其中c电极为纯铜,d电极为粗铜(含有杂质Fe、Ag),溶液是足量CuSO4溶液,通电一段时间后停止电解,A池a极上产生的气体在标准状况下为2.24L,则下列说法正确的是( )
如图所示,A池用石墨电极电解pH=13的Na0H溶液100mL,B池为模拟电解精炼铜的装置,其中c电极为纯铜,d电极为粗铜(含有杂质Fe、Ag),溶液是足量CuSO4溶液,通电一段时间后停止电解,A池a极上产生的气体在标准状况下为2.24L,则下列说法正确的是( )| A. | d电极质量一定减少6.4g | B. | c电极质量一定增加6.4g | ||
| C. | A池pH不变 | D. | A池溶液质量减少3.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 75mL 1mol/L的FeCl3溶液 | B. | 75mL 2mol/L 的NH4Cl溶液 | ||
| C. | 100mL 1.5mol/L 的KCl溶液 | D. | 150mL 1mol/L 的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NO2和N2O4之间发生反应:2NO2?N2O4(g),一定温度下,体积为2L的密闭容器中,各物质的物质的量随时间变化的关系如图所示.回答下列问题
NO2和N2O4之间发生反应:2NO2?N2O4(g),一定温度下,体积为2L的密闭容器中,各物质的物质的量随时间变化的关系如图所示.回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ①③⑤ | C. | ①②③④ | D. | 只有①③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com