
| A. | pH=1的溶液中:Na+、NH4+、SO42-、ClO- | |
| B. | KW/c(H+)=0.1 mol•L-1的溶液中:Na+、K+、MnO4-、HCO3- | |
| C. | 0.1 mol•L-1的Na2SO3溶液中:K+、H+、SO42-、NO3- | |
| D. | 澄清透明的溶液中:Fe3+、Na+、Cl-、SO42- |
分析 A.该溶液中存在大量氢离子,次氯酸根离子与氢离子反应生成次氯酸;
B.该溶液为碱性溶液,溶液中存在大量氢氧根离子,碳酸氢根离子与氢氧根离子反应;
C.硝酸根离子在酸性条件下能够氧化亚硫酸钠;
D.四种离子之间不发生反应,且为澄清透明的溶液.
解答 解:A.pH=1的溶液中存在大量氢离子,ClO-与氢离子反应生成次氯酸,在溶液中不能大量共存,故A错误;
B.KW/c(H+)=0.1 mol•L-1的溶液中,氢氧根离子浓度为0.1mol/L,HCO3-与氢氧根离子反应,在溶液中不能大量共存,故B错误;
C.H+、NO3-能够氧化Na2SO3,在溶液中不能大量共存,故C错误;
D.Fe3+、Na+、Cl-、SO42-之间不发生反应,且为澄清透明溶液,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识的能力.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 事实 | 解释 |
| A | 用热的纯碱溶液洗去油污 | Na2CO3可作为油脂分解的催化剂 |
| B | 铝罐车可用于运输稀硝酸 | 铝表面形成致密氧化膜具有保护作用 |
| C | 甘油作为化妆品中的保湿剂 | 甘油易与水形成氢键 |
| D | 氢氟酸刻蚀水晶工艺品 | HF具有强酸性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
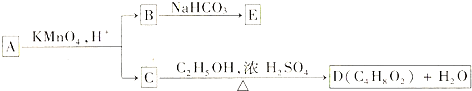
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 | |
| B. | 日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 | |
| C. | 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 | |
| D. | 神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是单晶硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向盛有少量Mg(OH)2沉淀的试管中滴加适量NH4Cl溶液,沉淀溶解:Mg(OH)2+2NH4+═2NH3•H2O+Mg2+ | |
| B. | SO2通入澄清石灰水中,产生白色沉淀:SO2+Ca2++2OH-═CaSO4↓+H2O | |
| C. | 向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++2 HCO3-+2 OH-═CaCO3↓+CO32-+2H2O | |
| D. | 长期过量服用阿司匹林出现水杨酸(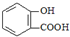 )反应,可静脉注滴NaHCO3溶液: )反应,可静脉注滴NaHCO3溶液: |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该溶液中氢离子的浓度:c(H+)=1×10-11 mol•L-1 | |
| B. | pH=7 的NH4Cl和NH3•H2O的混合溶液:c(Cl-)>c(NH4+)>c(H+)=c(OH-) | |
| C. | 浓度均为0.1 mol•L-1的NH3•H2O和NH4Cl溶液等体积混合后的碱性溶液中:c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+) | |
| D. | 0.1 mol•L-1的氨水与0.05 mol•L-1的 H2SO4溶液等体积混合后所得溶液中:2c(NH4+)+2c(NH3•H2O)=c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | N | S | O | Si |
| 原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
| A. | 0.80×10-10m | B. | 1.20×10-10m | C. | 1.10×10-10m | D. | 0.70×10-10m |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com