
(Ⅰ)(4分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)反应需要在闪电或极高温条件下发生,说明该反应_________。(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)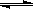 2NO(g)的平衡常数K如下表:
2NO(g)的平衡常数K如下表:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
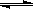 2NO(g)达到平衡时NO的浓度为 。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
2NO(g)达到平衡时NO的浓度为 。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)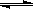 C(g)+D(g),不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题: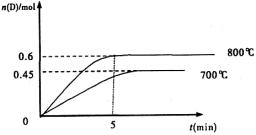
 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
 自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)反应需要在闪电或极高温条件下发生,说明该反应_________。(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)![]() 2NO(g)的平衡常数K如下表:
2NO(g)的平衡常数K如下表:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
①该反应的△H 0。
(填“>”、“=”或“<”)
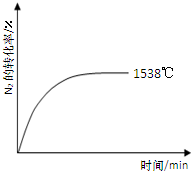
②其他条件相同时,在上述三个温度下分别发生该反应。1538℃时,N2的转化率随时间变化如右图所示,请补充完成1760℃、2404℃时N2的转化率随时间变化的示意图。
(3)2404℃时,在容积为1.0L的密闭容器中通入2.6mol N2和2.6mol O2,计算反应
N2(g)+O2(g) 2NO(g)达到平衡时NO的浓度。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
2NO(g)达到平衡时NO的浓度。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省高三第二次模拟考试化学试卷(解析版) 题型:填空题
(8分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)反应需要在闪电或极高温条件下发生,说明该反应_________。(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)
 2NO(g)的平衡常数K如下表:
2NO(g)的平衡常数K如下表:
|
温度/℃ |
1538 |
1760 |
2404 |
|
平衡常数K |
0.86×10-4 |
2.6×10-4 |
64×10-4 |
该反应的△H 0。(填“>”、“=”或“<”)
(3)一定条件下该反应在密闭容器中达到平衡后,要提高N2的转化率, 可以采取的措施是 。
A.降低温度 B.加催化剂
C.增加压强 D.增加O2浓度
E.分离出一氧化氮
(4)2404℃时,在容积为1.0L的密闭容器中通入2.6mol N2和2.6mol O2,计算反应:
N2(g)+O2(g)
 2NO(g)达到平衡时NO的浓度 。(此温度下不考虑O2与NO的反应,计算结果保留两位有效数字)
2NO(g)达到平衡时NO的浓度 。(此温度下不考虑O2与NO的反应,计算结果保留两位有效数字)
(5) NO在科学界被誉为“明星分子”, 用NO与O2反应可以制备NO2,NO2是一种优良的氧化剂。已知 火箭发射时可用肼(N2H4)作燃料,NO2作氧化剂,这两者反应生成N2和H2O(气)。
且:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ/mol
请写出肼与NO2反应的热化学方程式_______________________________________________
查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省高三第四次月考化学试卷 题型:填空题
(12分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)在不同温度下,反应N2(g)+O2(g) 2NO(g) △H=a kJ·mol-1的平衡常数K如下表:
2NO(g) △H=a kJ·mol-1的平衡常数K如下表:
|
温度/℃ |
1538 |
1760 |
2404 |
|
平衡常数K |
0、86×10-4 |
2、6×10-4 |
64×10-4 |
①该反应的△H 0(填“>”、“=”或“<”)。
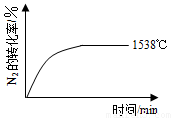
②其他条件相同时,在上述三个温度下分别发生该反应。1538℃时,N2的转化率随时间变化如图所示,
请补充完成1760℃时N2的转化率随时间变化的示意图。
(2)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。相应的热化学方程式如下:
2N2(g)+6H2O(1) =4NH3(g)+3O2(g) △H=+1530kJ·mol-1
则氨催化氧化反应4NH3(g)+5O2(g) =4NO(g)+6H2O(1) 的反应热△H= 。
(用含a的代数式表示)
(3)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为:N2+3H2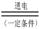 2NH3。则在电解法合成氨的过程中,应将H2不断地通入
极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
2NH3。则在电解法合成氨的过程中,应将H2不断地通入
极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
 (4)合成氨的反应N2(g)+3H2(g)
(4)合成氨的反应N2(g)+3H2(g)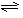 2NH3(g) △H =
-92、4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
2NH3(g) △H =
-92、4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
a、升高温度 b、加入催化剂 c、增加H2的浓度
d、增加N2的浓度 e、分离出NH3
(5)在25℃下,将a mol·L-1的氨水与0、01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”), 可推断a 0、01(填大于、等于或小于)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com