
一种二次电池如图所示,该电池的电解质为强碱溶液,下列说法中正确的是( )
A.充电时阴极发生氧化反应
B.充电时将碳电极与电源的正极相连
C.放电时碳电极反应为原电池的负极
D.放电时镍电极反应为Ni(OH)2-e-+OH-=NiO(OH)+H2O
科目:高中化学 来源:2017届广东省惠州市高三上第三次调研化学试卷(解析版) 题型:选择题
莽草酸是合成达菲的主要原料,其结构简式如图,下列说法正确的是:( )

A. 分子式为C7H8O5 B.能使溴的四氯化碳溶液褪色
C.只能发生加成反应和取代反应 D.分子中含有2种官能团
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上联考二化学卷(解析版) 题型:选择题
在强酸性无色溶液中,下列离子组能大量共存的是
A.Na+、K+ 、OH-、Cl- B.Na+、Cu2+、SO42-、NO3-
C.K+、Mg2+、SO42-、Cl- D.Ba2+、HCO32-、NO3-、K+
查看答案和解析>>
科目:高中化学 来源:2017届北京市海淀区高三上学期期末化学试卷(解析版) 题型:选择题
下列污水处理的方法中,表示其原理的离子方程式不正确的是
A.混凝法,用明矾做混凝剂:Al3++3H2O Al(OH)3+3H+
Al(OH)3+3H+
B.中和法,用过量CO2中和碱性废水:CO2+2OH—=CO32—
C.沉淀法,用Na2S处理含Hg2+废水:Hg2++S2—=HgS↓
D.氧化还原法,用FeSO4将酸性废水中Cr2O72—还原为Cr3+:Cr2O72—+6Fe2++14H+=2Cr3++6Fe3++7H2O
查看答案和解析>>
科目:高中化学 来源:2017届广东省肇庆市高三上学期二模化学试卷(解析版) 题型:实验题
砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
(l)冶炼废水中砷元素主要以亚砷酸(H3 AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
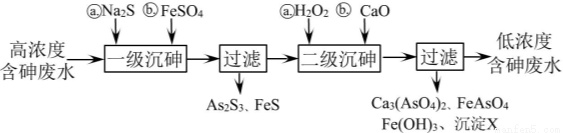
已知:I .As2 S3与过量的S2一存在以下反应:As2S3(s)+3S2—(aq) 2AsS33—(aq);
2AsS33—(aq);
II.亚砷酸盐的溶解性大于相应砷酸盐。
①亚砷酸中砷元素的化合价为 ;
②砷酸的第一步电离方程式为 ;
③“一级沉砷”中FeSO4的作用是 ;
④“二级沉砷”中H2O2与含砷物质反应的化学方程式为 ;
⑤沉淀X为 (填化学式)。
(2)冶炼废渣中的砷元素主要以As2O3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10 -6g)。
步骤1:取10 g废渣样品,粉碎后与锌粉混合,加人H2 SO4共热,生成H3As气体。
步骤2:将H3As气体通人AgNO3溶液中,生成银镜和As2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
①AsH3的电子式为 ;
②步骤2的离子方程式为 ;
③固体废弃物的排放标准中,砷元素不得高于4.0×10一5g·kg一1,请通过计算说明该排放的废渣中砷元素的含量 (填“符合”、“不符合”)排放标准,原因是 。
查看答案和解析>>
科目:高中化学 来源:2017届广东省深圳市三校高三上学期第一次联考化学卷(解析版) 题型:实验题
氯贝特( )是临床上一种降脂抗血栓药物,它的一条合成路线如下:
)是临床上一种降脂抗血栓药物,它的一条合成路线如下:
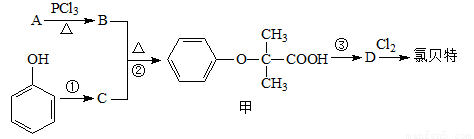
提示:Ⅰ.图中部分反应条件及部分反应物、生成物已略去。
Ⅱ.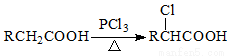
Ⅲ.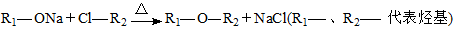
⑴氯贝特的分子式为 。
⑵若8.8 g A与足量NaHCO3溶液反应生成2.24 L CO2(标准状况),且B的核磁共振氢谱有两个峰,则A的结构简式为 。(相对原子质量:H-1、C-12、O-16)
⑶要实现反应①所示的转化,加入下列物质不能达到目的的是 (填选项字母)。
a.Na b.NaOH c.NaHCO3 d.CH3COONa
⑷反应②的反应类型为 ,其产物甲有多种同分异构体,同时 满足以下条件的所有甲的同分异构体有 种(不考虑立体异构)。
满足以下条件的所有甲的同分异构体有 种(不考虑立体异构)。
① 1,3,5-三取代苯;
② 属于酯类 且既能与FeCl3溶液显紫色,又能发生银镜反应;
且既能与FeCl3溶液显紫色,又能发生银镜反应;
③ 1 mol该同分异构体最多能与3 mol NaOH反应。
⑸写出B与足量NaO H溶液反应的化学方程式 。
H溶液反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2017届广东省深圳市三校高三上学期第一次联考化学卷(解析版) 题型:选择题
氢化亚铜(CuH)是一种不稳定的物质,能在氯气中燃烧,也能与酸反应。用CuSO4溶液和“某物质”在40~50℃时反应可生成CuH。下列叙述中错误的是( )
A.“某物质 ”具有还原性
”具有还原性
B.CuH与盐酸反应可能产生H2
C.CuH在氯气中燃烧:CuH+Cl2=CuCl+HCl
D.CuH与足量稀硝酸反应:CuH+3H++NO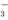 =Cu2++NO↑+2H2O
=Cu2++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源:2017届广东省韶关市高三上高考调研理综化学试卷(解析版) 题型:填空题
高纯度氢氧化镁广泛应用于医药、电力等领域。镁硅酸盐矿石可用于生产氢氧化镁,简要工艺流程如图所示:
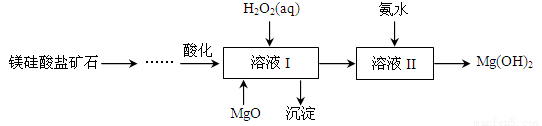
已知:①溶液I中除含Mg2+、SO42-外,还含少量Fe3+、Al3+、Fe2+等离子;
②Mg2+与氨水的反应为吸热反应。请回答下列问题:
(1)Mg在元素周期表中的位置为__________________。
(2)H2O2的电子式为________。溶液I中加入H2O2溶液发生反应的离子方程式是__________。
(3)向溶液I中首先加入的试剂是___________,产生沉淀的化学式为_________________。工业上有时只用一种含钠化合物替代H2O2和MgO,该试剂通常为___________(填化学式)。
(4)溶液II中Mg2+转化率随温度T的变化情况如图所示:
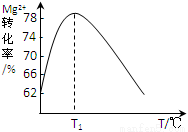
①向溶液II中加入氨水发生反应的离子方程式是______________________。
②T1前Mg2+转化率增大的原因是_________________;
查看答案和解析>>
科目:高中化学 来源:2017届四川省绵阳市高三1月诊断性考试化学试卷(解析版) 题型:填空题
A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C, B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(l) B、C中第一电离能较大的是_________,基态D原子价电子的轨道表达式为_______
(2) DA2分子的VSEPR模型是________。H3A比H2D熔沸点高得多的原因是_________。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6在加热时易升华,与过量的NaOH 溶液反应可生成Na[C(OH)4]
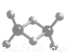
①C2Cl6属于_________晶体(填晶体类型),其中C原子的杂化轨道类型为______杂化。
②[C(OH)4]-中存在的化学健有__________。
(4)工业上制备B的单质是电解熔融B的氯化物,而不是电解BA,原因是_________。
(5)B、C的氯化物晶格能分别是2957KJ/mol、5492KJ/mol,二者相差很大的原因是________。
(6)D与E所形成化合物晶体的晶胞如右图所示。

①在该晶胞中,E的配位数为__________。
②原子坐标参数可表示晶胞内部各原子的相对位置。右图晶胞中,原子坐标参数a为(0,0,0);b为(1/2,0,1/2),c为(1/2,1/2,0).则d原子的坐标为__________。
③已知该晶胞的密度为ρg/cm3,则其中两个D,原子之间的距离为____pm(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com