
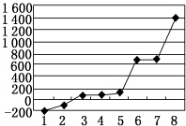
 红磷P(s)和Cl2(g)发生反应生成PCl3(g),继续反应生成PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g),继续反应生成PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).分析 (1)由图象可知,1molPCl3分解为1molP与1molCl2反应吸收306kJ的能量;
(2)分解为PCl5为0.8mol-0.60mol=0.2mol,进而计算PCl5的分解率;由图可知,PCl5的分解反应为吸热反应,升高温度平衡正向移动,PCl5的分解率增大;
(3)两步反应均为放热反应,降温有利于提高产率,防止产物分解;
(4)PCl5与足量水充分反应,最终生成两种酸,生成磷酸与HCl.
解答 解:(1)由图象可知,1molPCl3分解为1molP与1molCl2反应吸收306kJ的能量,则PCl3分解成P和Cl2的热化学方程式是:PCl3(g)═P (s)+$\frac{3}{2}$Cl2(g)△H=+306 kJ/mol,
故答案为:PCl3(g)═P (s)+$\frac{3}{2}$Cl2(g)△H=+306 kJ/mol;
(2)分解为PCl5为0.8mol-0.60mol=0.2mol,PCl5的分解率α1=$\frac{0.2mol}{0.8mol}$×100%=25%;
由图可知,PCl5的分解反应为吸热反应,升高温度平衡正向移动,PCl5的分解率增大,故α2>α1,
故答案为:25%;大于;
(3)先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5,是因为:两步反应均为放热反应,降温有利于提高产率,防止产物分解,
故答案为:两步反应均为放热反应,降温有利于提高产率,防止产物分解;
(4)PCl5与足量水充分反应,最终生成两种酸,生成磷酸与HCl,反应方程式为:PCl5+4H2O═H3PO4+5HCl,
故答案为:PCl5+4H2O═H3PO4+5HCl.
点评 本题考查化学平衡计算与影响因素、热化学方程式等,需要学生具备扎实的基础与灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 原铁和铝的物质的量相等 | |
| B. | 原盐酸的浓度为2mol•L-1 | |
| C. | 铁加入盐酸中的离子方程式为2Fe+6H+=2Fe3++3H2↑ | |
| D. | 盐酸与氢氧化钠溶液的物质的量浓度之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,N2将完全转化为NH3 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| C. | 达到化学平衡时,正反应和逆反应的速率都为零 | |
| D. | 达到化学平衡时,N2和H2的转化率相同且c(N2):c(H2)=1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素X.Y.Z.W在元素周期表中的相对位置如图所示,其中w原子的最外层电子数是最内层电子数的3倍.下列判断不正确的是( )
短周期元素X.Y.Z.W在元素周期表中的相对位置如图所示,其中w原子的最外层电子数是最内层电子数的3倍.下列判断不正确的是( )| A. | x与同主族且相邻元素的气态氢化物的沸点,前者高于后者 | |
| B. | 含Y元素的盐溶液有的显酸性,有的显碱性 | |
| C. | x的气态氢化物与w的最高价氧化物的水化物反应只能生成一种盐 | |
| D. | x与H、O元素形成的化合物可以组成一种盐,其中X.H.O元素原子个数之比为2:4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将40gNaOH溶解于1L水中配成的NaOH溶液 | |
| B. | 常温常压下将22.4LHCl气体溶于水配成1L的盐酸溶液 | |
| C. | 将1 L0.5mol/L的浓盐酸加热浓缩为0.5L | |
| D. | 从1000mL 1mol/L NaCl溶液中取出100 mL的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 元素 | o | p | |
| 电离能kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 | |
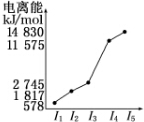
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能溶于浓盐酸或浓硝酸中 | |
| B. | 都能溶于氢氧化钠溶液中 | |
| C. | 它们的熔点都很高,常用做耐火材料 | |
| D. | 常温下都不能与水反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com