
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1mol CO、2mol H2 | 1mo l CH3OH | 2mol CH3OH | |
| 平衡时数据 | CH3OH的 浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | a kJ | b kJ | c kJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
分析 (1)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
(2)①升高温度,可逆反应向吸热反应方向移动,根据平衡常数与温度变化关系确定焓变;
②转化率=$\frac{n(CO)反应}{n(CO)起始量}$,根据平衡浓度计算出平衡常数来确定温度;
(3)要提高CO的转化率,必须使可逆反应向正反应方向移动;
(4)A.甲、丙相比较,把甲等效为开始加入1molCH3OH,丙中甲醇的物质的量为甲的2倍,压强增大,对于反应CH3OH(g)?CO(g)+2H2(g),平衡向生成甲醇的方向移动;
B.由题目可知生成1molCH3OH的能量变化为$\frac{454KJ}{5}$=90.8kJ,甲、乙平衡状态相同,平衡时相同物质的物质的量相等,令平衡时甲醇为nmol,计算反应热数值;
C.比较乙、丙可知,丙中甲醇的物质的量为乙的2倍,压强增大,对于反应CH3OH(g)?CO(g)+2H2(g),平衡向生成甲醇的方向移动;
D.甲、乙处于相同的平衡状态,则α1+α2=1,由C的分析可知α2>α3.
解答 解:(1)A.无论反应是否达到平衡状态,生成CH3OH的速率与消耗CO的速率始终相等,所以不能作为判断平衡状态的依据,故错误;
B.混合物的质量始终不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为判断平衡状态的依据,故错误;
C.反应前后,混合气体的物质的量改变,气体的质量不变,反应达到平衡状态时,混合气体的相对平均分子质量不变,所以能作为判断平衡状态的依据,故正确;
D.反应达到平衡状态时,CH3OH、CO、H2的浓度都不再发生变化,所以能作为判断平衡状态的依据,故正确;
故选CD,
故答案为:CD;
(2)①升高温度,平衡向吸热方向移动,根据表格知,温度越高,化学平衡常数越小,说明平衡向逆反应方向移动,所以正反应是放热反应,即△H<0,
故答案为:<;
②平衡时一氧化碳的物质的量=0.2mol/L×2L=0.4mol,转化率=$\frac{n(CO)反应}{n(CO)起始量}$=$\frac{(1-0.4)mol}{2mol}$×100%=80%,
CO(g)+2H2(g)?CH3OH(g)单位为mol/L
反应开始 1mol/L 3mol/L 0
反应 0.8mol/L 1.6mol/L 0.8mol/L
平衡 0.2mol/L 1.4mol/L 0.8mol/L
平衡常数K=$\frac{0.8mol/L}{2mol/L×(1.4mol/L)^{2}}$=2.04,所以是250℃;
故答案为:80%;250℃;
(3)A.该反应是放热反应,升高温度平衡向逆反应方向移动,故A错误;
B.催化剂对平衡移动无影响,故B错误;
C.增加CO的浓度,平衡向正反应方向移动,但CO的转化率降低,故C错误;
D.加入H2加压,平衡向正反应方向移动,一氧化碳的转化率增大,故D正确;
E.加入惰性气体加压,参加反应的气体压强不变,平衡不移动,故E错误;
F.分离出甲醇,平衡向正反应方向移动,一氧化碳的转化率增大,故F正确;
故答案为:DF;
(4)A.甲、丙相比较,把甲等效为开始加入1molCH3OH,丙中甲醇的物质的量为甲的2倍,压强增大,对于反应CH3OH(g)?CO(g)+2H2(g),平衡向生成甲醇的方向移动,故2c1<c3,故A错误;
B.由题目可知生成1molCH3OH的能量变化为$\frac{454KJ}{5}$=90.8kJ,甲、乙平衡状态相同,平衡时相同物质的物质的量相等,令平衡时甲醇为nmol,对于甲容器,a=90.8n,对应乙容器b=90.8(1-n),故a+b=90.8,故B错误;
C.比较乙、丙可知,丙中甲醇的物质的量为乙的2倍,压强增大,对于反应CH3OH(g)?CO(g)+2H2(g),平衡向生成甲醇的方向移动,故2p2>p3,故C错误;
D.甲、乙处于相同的平衡状态,则α1+α2=1,由C的分析可知α2>α3,所以a1+a3<1,故D正确,
故答案为:D.
点评 本题考查了影响化学平衡移动的因素、平衡状态的判断、平衡常数的计算、等效平衡问题等知识点,易错选项是(3)C,注意理解等效平衡问题、加入CO虽然能使平衡向正反应方向移动,但一氧化碳的转化率降低,为易错点,题目难度中等,


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 砹化氢(HAt)很稳定 | B. | 单质砹易溶于某些有机溶剂 | ||
| C. | 砹的原子半径比碘的原子半径大 | D. | 单质砹是有色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5molAl与足量盐酸反应转移电子数为1NA | |
| B. | 标准状况下22.4LH2中含中子数为2 NA | |
| C. | 0.5mol CH4所含电子数为5 NA | |
| D. | 1L1 mol/L醋酸溶液中离子总数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+ Na+ MnO4- SO42- | B. | Na+ CO32- Al3+ Cl- | ||
| C. | K+ Na+ Cl- SO42- | D. | K+ Cl- Ba2+ HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解食盐水若产生2g氢气,则转移的电子数目为NA | |
| B. | 电解精炼铜时转移0.1 NA个电子,则阳极溶解3.2g铜 | |
| C. | VL amol/L FeCl3 溶液中,若Fe3+数目为NA,则Cl-的数目大于3NA | |
| D. | 100mL 1mol/L的醋酸溶液中,CH3COO-离子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
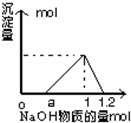 往Al2(SO4)3与H2SO4混合溶液中逐滴加入NaOH溶液,所得沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则Al2(SO4)3与H2SO4的物质的量浓度之比为( )
往Al2(SO4)3与H2SO4混合溶液中逐滴加入NaOH溶液,所得沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则Al2(SO4)3与H2SO4的物质的量浓度之比为( )| A. | 1:3 | B. | 1:4 | C. | 1:1 | D. | 1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com