
| n |
| V |
| 33.6L |
| 22.4L/mol |
| 3mol |
| 0.5L |


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
| A、HA在水中有0.001%发生电离 |
| B、HA的电离平衡常数K=10-8mol/L |
| C、升高温度时,PH增大 |
| D、由HA电离出的c(H+)约为水电离出的c(H+)的106倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、恒温,压缩体积,平衡不移动,混合气体颜色加深 |
| B、恒压,充入HI(g),开始时正反应速率减小 |
| C、恒容,升高温度,逆反应速率减小 |
| D、恒容,充入H2,再次达到平衡时H2(g)的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生铁中含有碳,抗腐蚀能力比纯铁弱 |
| B、用锡焊接的铁质器件,焊接处易生锈 |
| C、在铁制品上镀铜时,镀件为阳极,铜盐为电镀液 |
| D、电解精炼铜时,电解质溶液中铜离子浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
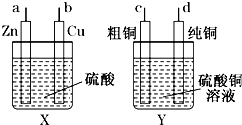
| A、a应与c相连接,b应与d相连接 |
| B、电解一段时间,b与d两极析出物质的物质的量相等 |
| C、电解一段时间,b极附近溶液的pH降低 |
| D、电解过程中,Y装置中Cu2+的浓度始终不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两者的分散质都属于碱 |
| B、两者均为有色不透明的分散系 |
| C、两者分散质的直径都介于10-9~10-7m之间 |
| D、一束光线分别通过时,两者都会产生“丁达尔效应” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com