
【题目】红矾钠(Na2Cr2O7·2H2O)广泛用作强氧化剂、鞣革剂。以铬矿石(主要成分为Cr2O3,还含有FeO、Al2O3、SiO2等杂质)为原料制取红矾钠的流程如下:

已知:①CrO42-与Cr2O72-存在如下平衡:2CrO42-+2H+![]() Cr2O72-+H2O,当pH<3时,以Cr2O72-为主,当pH>9时,以CrO42-为主。
Cr2O72-+H2O,当pH<3时,以Cr2O72-为主,当pH>9时,以CrO42-为主。
②钠盐在不同温度下的溶解度(g):
温度(℃) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
Na2SO4 | 9.0 | 19.4 | 40.8 | 48.8 | 46.7 | 45.3 | 44.1 | 43.7 |
Na2Cr2O7 | 170.2 | 180.1 | 196.7 | 220.5 | 248.4 | 283.1 | 323.8 | 385.4 |
注32.38℃以上,与饱和溶液平衡的固相为无水Na2SO4,以下则为Na2SO4·10H2O。
③Cr3+完全沉淀时pH为6.8,Cr(OH)3开始溶解时pH为12。
请回答下列问题:
(1)煅烧铬矿石时,生成Na2CrO4的化学反应方程式为_________
(2)滤渣Ⅱ的成分是__________(填化学式)。
(3)有人认为工艺流程中“用稀硫酸调pH”改为“通入过量CO2”,不需调节pH同样可以达到实验效果,理由是___________。
(4)向红矾钠溶液中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到________
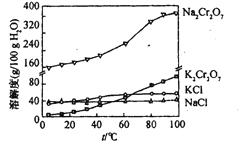
A.80 B.60 C.40 D.10
(5)该工艺所得副产品主要为无水硫酸钠并混有少量重铬酸钠,请设计从副产品获得芒硝(Na2SO4·10H2O)的实验方案:将该副产品按固液质量比100:230溶于热水,加入稍过量的Na2SO3溶液,搅拌,____,过滤,洗涤,低温干燥。(实验中须使用的试剂:稀H2SO4、NaOH溶液)。
【答案】 2Cr2O3+4Na2CO3+ 3O2![]() 4Na2CrO4+4CO2↑ H2SiO3、 Al(OH)3 过量的CO2不会使Al(OH)3溶解 生成的NaHCO3在后续步骤中加入稀硫酸可以除去 D 缓缓加入稀H2SO4,静置,冷却自然结晶,过滤,将晶体用热水溶解,加入适量NaOH溶液至溶液pH约为6.8~12,趁热过滤,将滤液冷却自然结晶
4Na2CrO4+4CO2↑ H2SiO3、 Al(OH)3 过量的CO2不会使Al(OH)3溶解 生成的NaHCO3在后续步骤中加入稀硫酸可以除去 D 缓缓加入稀H2SO4,静置,冷却自然结晶,过滤,将晶体用热水溶解,加入适量NaOH溶液至溶液pH约为6.8~12,趁热过滤,将滤液冷却自然结晶
【解析】(1)铬矿石与Na2CO3以及O2在加热的条件下生成Na2CrO4和CO2,反应的方程式为:2Cr2O3+4Na2CO3+ 3O2![]() 4Na2CrO4+4CO2↑。答案为:2Cr2O3+4Na2CO3+ 3O2
4Na2CrO4+4CO2↑。答案为:2Cr2O3+4Na2CO3+ 3O2![]() 4Na2CrO4+4CO2↑
4Na2CrO4+4CO2↑
(2)滤液I中加入稀硫酸调节PH可生成H2SiO3和Al(OH)3沉淀,因此滤渣Ⅱ的成分是H2SiO3、 Al(OH)3。答案为:H2SiO3、 Al(OH)3
(3)通入过量CO2,可以生成Al(OH)3和H2SiO3沉淀,过量的CO2不会溶解Al(OH)3,生成的NaHCO3加入稀硫酸可以除去。答案为:过量的CO2不会使Al(OH)3溶解,生成的NaHCO3在后续步骤中加入稀硫酸可以除去
(4)向红矾钠溶液中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体,由溶解度图示可知,冷却到10℃时得到的K2Cr2O7固体最多。答案为:d
(5) 要从副产品获得芒硝,可以设计如下的实验方案:将该副产品按固液质量比100:230溶于热水,加入稍过量的Na2SO3溶液,搅拌,向所得的溶液中加入稀硫酸,然后静置,让溶液冷却自然结晶。对静置后的溶液进行过滤,将得到的晶体溶于热水中,然后加入适量的NaOH溶液调节pH约为6.8![]() 12,趁热过滤,将得到的滤液冷却自然结晶,得到芒硝。答案为:缓缓加入稀H2SO4,静置,冷却自然结晶,过滤,将晶体用热水溶解,加入适量NaOH溶液至溶液pH约为6.8~12,趁热过滤,将滤液冷却自然结晶。
12,趁热过滤,将得到的滤液冷却自然结晶,得到芒硝。答案为:缓缓加入稀H2SO4,静置,冷却自然结晶,过滤,将晶体用热水溶解,加入适量NaOH溶液至溶液pH约为6.8~12,趁热过滤,将滤液冷却自然结晶。


科目:高中化学 来源: 题型:
【题目】HOOC(CH2)3COOH所在同分异构体在下列一种表征仪器中显示的信息(成数据)完全相同,该仪器是( )
A. 元素分析仪B. 红外光谱仪C. 质谱仪D. 核磁共振仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(1)Zn(s)+1/2O2(g)==ZnO(s),ΔH= -348.3kJ/mol (2) 2Ag(s)+1/2 O2(g)== Ag2O(s),ΔH= -31.0kJ/mol 则ZnO(s)+ 2Ag(s)== Zn(s)+ Ag2O(s)的ΔH等于( )
A. -317.3kJ/molB. -379.3kJ/molC. -332.8 kJ/molD. 317.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的图解表示构成细胞的元素、化合物,a、b、c、d代表不同的小分子物质,A、B、C代表不同的大分子物质,请分析回答下列问题:
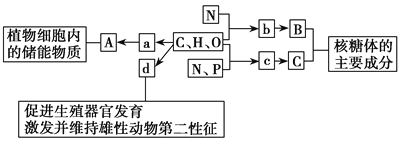
(1)物质a是_________,在动物细胞内,与物质A作用最相近的物质是_________。若物质A在动物、植物细胞中均可含有,并且作为细胞内最理想的储能物质,不仅含能量多而且体积较小,则A是______________。
(2)物质b是____________,若某种B分子由n个b分子(平均相对分子质量为m)组成的2条链组成,则该B分子的相对分子质量大约为____________。
(3)物质c在人体细胞中共有_______种,分子中___________的不同决定了c的种类不同。
(4)物质d是____________,d和__________、维生素D都属于固醇类物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、M、X、Y、Z为原子序数依次增大的前四周期元素,非金属元素W所在周期数等于族序数;M最外层电子数是电子层数的两倍;X与M同族,X单质与O2反应生成化合物XO2;Y 是第三周期原子半径最小的元素;Z是生活中常见金属,既不属于主族,也不属于副族。回答下列问题:
(1) W与M可以形成多种化合物,写出其中最简单化合物的电子式_____________。
(2) 已知:①X的单质结构为( ,每个X原子周围都与4个X成键形成的庞大结构);化合物XO2结构为(
,每个X原子周围都与4个X成键形成的庞大结构);化合物XO2结构为( ,每个X与4个O成键,每个O都与2个X成键形成的庞大结构)。
,每个X与4个O成键,每个O都与2个X成键形成的庞大结构)。
②有关键能的数据如下表:
化学键 | X-O | O=O | X-X |
键能(kJ/mol) | 460 | 498.8 | 176 |
写出单质X 在O2中燃烧的热化学方程式________________________。(用具体元素符号书写方程式)
(3) 写出Z的单质与H2O反应的化学方程式_____________________________________。
(4)Y和Z形成的化合物的水溶液呈酸性的原因_______________________________(用离子方程式解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事故处理方法正确的是
A.电线短路失火时,用大量的水灭火
B.NaOH浓溶液溅到皮肤,立即用水冲洗,然后涂上稀硼酸溶液
C.浓硫酸溅到皮肤上,立即用稀 NaOH 溶液洗涤
D.钠着火时,立即用水灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,水既不是氧化剂,也不是还原剂,但反应是氧化还原反应的是( )
A. Na2O+H2O=2NaOH B. Cl2+H2O=HCl+HClO
C. C+H2O=CO+H2 D. 2F2+2H2O=4HF+O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com