
分析 根据浓硫酸具有吸水性,增重10.8g,为水的质量,可求得烃中H原子个数,生成物通入碱溶液,增重的质量为二氧化碳的质量,可求得烃中C原子个数,以此可求得烃的分子式,根据计算结果结合同分异构体的书写原则写出其可能结构.
解答 解:(1)浓硫酸增重的12.6g为水的质量,则n(H2O)=$\frac{12.6g}{18g/mol}$=0.7mol,n(H)=2n(H2O)=2×0.2mol=1.4mol,即0.1mol烃中含有1.4molH原子,该烃分子中H原子个数=$\frac{1.4mol}{0.1mol}$=14,
浓氢氧化钠溶液增重的26.4g为二氧化碳的质量,则n(CO2)=$\frac{26.4g}{44g/mol}$=0.6mol,n(C)=n(CO2)=0.6mol,即0.1mol烃中含有0.6molC原子,该烃分子中C原子个数=$\frac{0.6mol}{0.1mol}$=6,
所以该烃的分子式为C6H14,
答:该烃的分子式为C6H14;
(2)该烃的分子式为C6H14,为己烷,
主链为6个碳原子时:CH3CH2CH2CH2CH2CH3;
主链为5个碳原子时:(CH3)2CHCH2CH2CH3、CH3CH2CH(CH3)CH2CH3;
主链为4个碳原子时:(CH3)2CHCH(CH3)2、(CH3)3CCH2CH3 ,
答:该烃的同分异构体的有:CH3CH2CH2CH2CH2CH3、(CH3)2CHCH2CH2CH3、CH3CH2CH(CH3)CH2CH3、(CH3)2CHCH(CH3)2、(CH3)3CCH2CH3 .
点评 本题考查有机物分子式、结构简式的确定,题目难度不大,侧重于学生的分析、计算能力的考查,根据原子守恒法来解答,注意掌握同分异构体的书写原则.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3CH(OH)CH2COOH系统命名法命名3-羟基丁酸 | |
| B. | 四苯基乙烯(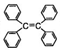 )中所有碳原子一定处于同一平面 )中所有碳原子一定处于同一平面 | |
| C. | lmol 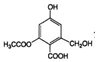 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别是3mol、4mol、1mol 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别是3mol、4mol、1mol | |
| D. | 在一定条件下,苯与液溴、浓硝酸生成溴苯、硝基苯的反应都属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
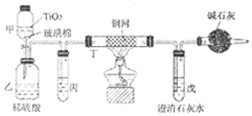
 .
.| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a电极是该电池的负极,发生氧化反应 | |
| B. | b电极反应式为2NO3-+10e-+12H+═N2↑+6H2O | |
| C. | 电池工作时,H+由左室通过质子交换膜进入右室 | |
| D. | 转化室中发生反应后溶液的pH增大(忽略体积变化) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
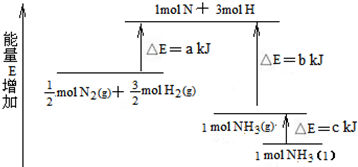
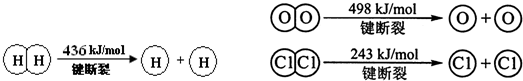
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物 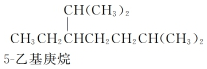 的名称为2,6二甲基5乙基庚烷 的名称为2,6二甲基5乙基庚烷 | |
| B. | 丙氨酸和苯丙氨酸脱水,最多可生成3种二肽 | |
| C. | 化合物  是苯的同系物 是苯的同系物 | |
| D. | 三硝酸甘油酯的分子式为C3H5N3O9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是离子化合物,含有离子键和共价键 | |
| B. | 电子式是: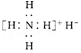 | |
| C. | 与水反应时,氢化铵被氧化 | |
| D. | 固体投入少量的水中,有两种气体产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com