
已知某可逆反应在密闭容器中进行:A(g)+2B(g) 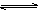 3C(g)+D(s) △H<0,下图中曲线a 代表一定条件下该反应的过程,若使a曲线变为b曲线, 可采用的措施是 ( )C
3C(g)+D(s) △H<0,下图中曲线a 代表一定条件下该反应的过程,若使a曲线变为b曲线, 可采用的措施是 ( )C
A.增大A的浓度 B.增大容器的体积
C.加入催化剂 D.升高温度

科目:高中化学 来源: 题型:
用惰性电极电解Fe2(SO4)3和CuSO4的混合溶液,且已知2Fe3++Cu=2Fe2++Cu2+,下列说法正确的是
A.阴极上不可能析出铜
B.阴极上首先析出铁,然后析出铜
C.首先被电解的是Fe2(SO4)3溶液,后被电解的是CuSO4溶液
D.阴极反应式为:Cu2++2e— =Cu,当有Cu2+存在时,Fe3+不放电
查看答案和解析>>
科目:高中化学 来源: 题型:
酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
回答下列问题:
(1) SnCl2用盐酸而不用水直接溶解的原因是:
加入锡粉的作用是:
(2) 反应I生成的沉淀为SnO,写出该反应的化学方程式:
(3) 检验沉淀已经“洗涤”干净的操作是: (3分)
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH。若溶液中c(Sn2+)=1.0mol·L—1,则室温下应控制溶液pH 。(已知:Ksp[Sn (OH)2]=1.0×10—26)
(OH)2]=1.0×10—26)
(5)酸性条件下,SnSO4还可用作双氧水的去除剂,试写出所发生反应的离子方程式:
。
(6)潮湿环境中,镀锡铜即使锡层破损也能防止形成铜绿,请结合有关的原理解释其原因:

查看答案和解析>>
科目:高中化学 来源: 题型:
淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:
① 将1∶1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30 min,然后逐渐将温度降至60℃左右;
② 将一定量的淀粉水解液加入三颈烧瓶中;
③ 控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④ 反应3h左右,冷却,减压过滤后得草酸晶体粗品,再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的目的是: 。
(2)冷凝水的进口是 (填a或b);实验中若混酸滴加过快,将导致草酸产量下降,其原因是 。
(3)装置B的作用是 。为使尾气充分吸收,C中试剂是 。
(4)重结晶时,将草酸晶体粗品经①加热溶解、②趁热过滤、③冷却结晶、④过滤洗涤⑤干燥等实验步骤,得到较纯净的草酸晶体。该过程中可将粗品中溶解度较大的杂质在 (填上述步骤序号)时除去;而粗品中溶解度较小的杂质最后留存在 (填“滤纸上”或“滤液中”)。
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸。用KMnO4标准溶液滴定,该反应的离子方程式为:
 称取该样品0.1200 g,加适量水完全溶解,然后用0.02000 mol·L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),滴定前后滴定管中的液面读数如图所示,则该草酸晶体样品中二水合草酸的质量分数为 。
称取该样品0.1200 g,加适量水完全溶解,然后用0.02000 mol·L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),滴定前后滴定管中的液面读数如图所示,则该草酸晶体样品中二水合草酸的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.常温常压下,只有一种元素的单质呈液态
B.元素周期表中所有元素都是从自然界中发现的
C.过渡元素不全是金属元素
D.常温常压下,气态单质的分子都是由非金属元素的原子形成的
查看答案和解析>>
科目:高中化学 来源: 题型:
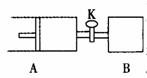
如右图,关闭活塞K,向A中充入1 molX、1 molY,向B中充入2 molX、2 molY, 此时A、B的容积都是a L。在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g)  2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是( )
2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是( )
A、 反应速率:v(B)<v(A)
B、A 容器中X的转化率为80%
C、平衡时的压强:2p(A)=p(B)
D、平衡时Y的体积分数:A>B
查看答案和解析>>
科目:高中化学 来源: 题型:
FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1︰1︰1时,实际参加反应的FeS与HNO3的物质的量之比为( )
A.1∶6 B.1∶7 C.2∶11 D.16∶25
查看答案和解析>>
科目:高中化学 来源: 题型:
已知N2(g)+3H2(g) 2NH3(g) △H=−92.4 kJ·mol-1,在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
2NH3(g) △H=−92.4 kJ·mol-1,在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1 mol N2、3 mol H2 | 2 mol N2、6 mol H2 | 2 mol NH3 |
| NH3的浓度(mol·L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 放出Q2 kJ | 吸收Q3 kJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
A.Q3+92.4c1=92.4 B.α2+α3<1
C.2p1=2p3<p2 D.达到平衡时丙容器中NH3的体积分数最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com