





 ,B为单质Al,核电荷数为13,原子核外有3个电子层,最外层电子数为3,原子结构示意图为
,B为单质Al,核电荷数为13,原子核外有3个电子层,最外层电子数为3,原子结构示意图为 ,1个水分子中含有2个氢氧共价键,结构式为H-O-H,氢气在氯气中燃烧,产生苍白色火焰,生成的HCl易溶于水,能产生白雾,
,1个水分子中含有2个氢氧共价键,结构式为H-O-H,氢气在氯气中燃烧,产生苍白色火焰,生成的HCl易溶于水,能产生白雾, ;
; ;H-O-H; 苍白色火焰(产生白雾);
;H-O-H; 苍白色火焰(产生白雾);| 2g |
| 2g/mol |


科目:高中化学 来源: 题型:
 (2011?江山市模拟)第28届夏季奥运会在北京成功举办,向世界人民展示了中国人的风采和北京的魅力.奥运五环象征着五大洲的团结以及全世界运动员以公正、坦率的比赛和友好的精神.“北京欢迎您”不仅是北京奥运会的主题歌也是吉祥物的“名字”也正好是五个环相一致(如图所示).
(2011?江山市模拟)第28届夏季奥运会在北京成功举办,向世界人民展示了中国人的风采和北京的魅力.奥运五环象征着五大洲的团结以及全世界运动员以公正、坦率的比赛和友好的精神.“北京欢迎您”不仅是北京奥运会的主题歌也是吉祥物的“名字”也正好是五个环相一致(如图所示).





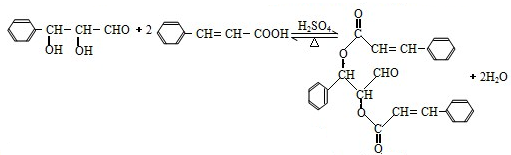

 或
或
 或
或
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:2010-2011学年辽宁省大连二十四中高一(下)期中化学试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com