
| A. | CH4与P4的分子结构都是正四面体形,因此在6.02×1023个CH4分子或P4分子中都含有4×6.02×1023个共价键 | |
| B. | 在含6.02×1023个硅原子的二氧化硅晶体中含有4×6.02×1023个Si-O键 | |
| C. | 28g CO、C2H4混合气体的分子总数NA,体积约为22.4L | |
| D. | 6.02×1023个Fe3+完全水解可以得到6.02×1023个氢氧化铁胶体粒子 |
分析 A、甲烷中含4条C-H键,而白磷中含6条p-p键;
B、含6.02×1023个硅原子的二氧化硅晶体的物质的量为1mol,而1mol二氧化硅中含4molSi-O键;
C、没有指明标况,不能计算;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体.
解答 解:A、甲烷含4条C-H键,而白磷含6条p-p键,故6.02×1023个CH4分子中含4molC-H键,即4NA个;6.02×1023个P4分子中含6molp-p键,即6NA个,故A错误;
B、1mol二氧化硅含1mol硅原子,故含6.02×1023个硅原子的二氧化硅晶体的物质的量为1mol,而1mol二氧化硅中含4molSi-O键,即4NA条,故B正确;
C、28g CO、C2H4混合气体的分子总数NA,但是没有指明标况下,不能用公式计算,故C错误;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故得到的氢氧化铁胶粒小于NA个,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
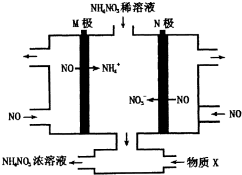
| A. | M极连接直流电源的正极 | |
| B. | 阳极上的电极反应为:NO-3e-+4OH-=NO3-+2H2O | |
| C. | 为使电解产物全部转化为NH4NO3浓溶液,需补充的物质X,则X为NH3 | |
| D. | 装置中加入稀NH4NO3溶液的目的是为了提高溶液的导电能力,可用NaNO3溶液代替 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 最高正化合价:Z>X | |
| B. | X、Y、Z的单质中,Z单质的熔点最高 | |
| C. | 若X为非金属元素,则离子半径:Xn->Ym->Zm- | |
| D. | X最高价氧化物对应的水化物,要么是强酸,要么是强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鼓励使用太阳能、风能等淸洁能源能减少PM2.5的污染 | |
| B. | 用含有橙色酸性K2Cr207的仪器检验酒驾,利用了乙醇的挥发性和氧化性 | |
| C. | 粮食酿酒的制造原理为淀粉水解变成葡萄糖,葡萄糖再水解得到酒精 | |
| D. | 与铜质水龙头连接处的钢质水管易发生析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
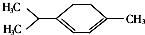 青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,关于该有机物的有关说法正确的是( )
青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,关于该有机物的有关说法正确的是( )| A. | 该有机物的一氯取代物有(不含立体异构)8种 | |
| B. | 该有机物位于同一平面内的碳原子最多有10个 | |
| C. | 该有机物难溶于水,可发生加成、氧化和聚合反应 | |
| D. | 该有机物的最简式为C5H8,与甲苯互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C8H10含苯环的烃同分异构体有3种 | |
| B. | 丙烯酸(CH2=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)是同系物 | |
| C. | 油脂在一定条件下水解成高级脂肪酸和甘油,称为皂化反应 | |
| D. | 青蒿素是抗疟疾特效药,结构如图所示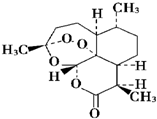 ,有酯基、过氧键和醚键,不溶于水,易溶于氯仿、丙酮等,可以用乙醚从植物中提取,能够发生水解反应,具有强氧化性 ,有酯基、过氧键和醚键,不溶于水,易溶于氯仿、丙酮等,可以用乙醚从植物中提取,能够发生水解反应,具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液的体积/ml | 25.52 | 25.02 | 24.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
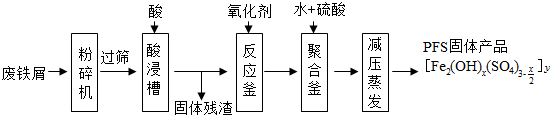
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com