
| A. | 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-(b+a) kJ/mol | |
| B. | N2H4(g)+$\frac{1}{2}$N2O4(g)=$\frac{3}{2}$N2(g)+2H2O(g);△H=-(2b+a)kJ/mol | |
| C. | 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-(a-2b) kJ/mol | |
| D. | 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-(b-a) kJ/mol |
分析 已知①N2(g)+2O2(g)═N2O4(g),△H=+aJ/mol;②N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=-bkJ/mol;利用盖斯定律将②×2-①可得2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g),并以此计算反应热.
解答 解:已知①N2(g)+2O2(g)═N2O4(g),△H=+akJ/mol,
②N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=-bJ/mol,
利用盖斯定律将②×2-①可得2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g),△H=(-bmol)×2-(+akJ/mol)=-(2b+a)KJ/mol,
故选B.
点评 本题考查反应热的计算、盖斯定律的应用,题目难度中等,明确盖斯定律的内容及其应用方法为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用pH计测定酸碱度,结论为pH为1或13 | |
| B. | 加入NaHCO3粉末,可能生成CO2 | |
| C. | 加人铝片,一定能生成H2 | |
| D. | 滴人NaOH溶液,-lg[OH-]一定减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中存在大量单质硅 | |
| B. | 石英、水晶、硅石的主要成分都是二氧化硅 | |
| C. | 常温下硅性质活泼,能与氯气、强酸反应 | |
| D. | 自然界中的硅是以二氧化硅或硅酸盐的形式存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在硝酸亚铁溶液中:Al3+、H+、SO42-、Cl- | |
| B. | 在透明溶液中:Fe3+、Mg2+、NO3-、HCO3- | |
| C. | 在含SO2的溶液中:Fe3+、Na+、Cl-、SO42- | |
| D. | pH=0的溶液中:NH4+、Fe2+、SO42-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
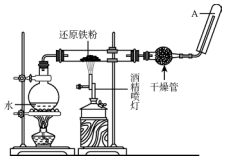 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应,应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应,应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com